Сичікова Я.О.
Бердянський державний педагогічний університет
Енергетичні
рівні в напівпровіднику та в електроліті
Контакт
напівпровідника з електролітом є більш складною системою в порівнянні з
контактом між двома різними напівпровідниками. Напівпровідник характеризується
електронною провідністю, електроліт – іонною. Різні агрегатні стани (тверде
тіло, електроліт) вносять специфіку в фізичні та фізико-хімічні властивості
міжфазної границі [1].
Розглядаючи
властивості контакту «напівпровідник-електроліт», можна провести ряд аналогій з
бар'єром Шотткі, якщо додатково враховувати окислювально-відновні реакції на
поверхні напівпровідника [2].
Розглянемо
електроліт. Іони в електроліті можуть знаходитися у відновленому (reduced) або
окисленому (oxidized) станах. Перехід з одного стану в інший здійснюється за
участю електрона і описується реакцією [3, 4]
![]() , (1)
, (1)
де n - число
електронів, що беруть участь в ній.
Електрохімічний
потенціал (Рівень Фермі) електрона в окислювально – відновному електроліті
згідно рівняння Нернста [5] дорівнює:
![]() ,
(2)
,
(2)
де E0
redox - рівноважний стандартний потенціал;
n - число
моль електронів, що беруть участь в процесі електронного обміну між
окислювальною та відновною формами речовини в сольватованому стані;
Cox
і Cred - концентрація окислювальної та відновної складових
редокс-пари в електроліті.
Для кожного
компонента редокс-пари гауссовий розподіл енергії має вигляд (рис. 1) [2 - 6]:
![]() (3)
(3)
![]() (4)
(4)
Розподіл
характеризується так званою енергією реорганізації λ. Гауссовий розподіл
енергетичних рівнів в електроліті має напівширину 2(λkT)1/2.
Положення
рівня Eredox щодо рівня Фермі в напівпровіднику визначає властивості
межі розділу напівпровідника з розчином.
Визначити
відносне положення рівня Eredox щодо рівня Фермі можна шляхом
встановлення кількісної відповідності між «фізичною» шкалою енергій і
електрохімічною шкалою електродних потенціалів [5, 6].
Енергію
електрона прийнято відраховувати від рівня енергії електрона в вакуумі.
Електродний потенціал – це різниця електричних потенціалів між електродом і
електролітом, що перебуває з ним у контакті.
Практичне
значення мають відносні електродні потенціали, що представляють собою різницю
електродних потенціалів розглянутого електрода і електрода порівняння -
найчастіше нормального водневого електроду, абсолютний потенціал якого дорівнює
4,5 eV.
Рівняння, що
встановлює зв'язок між так званою фізичною шкалою енергій і електрохімічною
шкалою електродних потенціалів, має вигляд:
EFredox= - 4,5 eV - eEredox
(5)
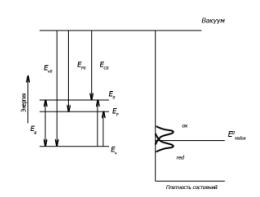
Рис.
1. Енергетичні рівні в напівпровіднику (ліворуч) і в
окислювально-відновлюваному електроліті (праворуч)
При зануренні напівпровідника в електроліт термодинамічна рівновага досягається
за рахунок протікання на межі розділу різних електронних та іонних обмінних
процесів. Електричні заряди протилежного знаку – електрони і дірки в
напівпровіднику і іони в електроліті – будуть скупчуватися по обидва боки межі
розділу, створюючи електричне поле. Виникає деяка різниця потенціалів, звана
Гальвані-потенціалом – компенсуюча різниця хімічних потенціалів двох
контактуючих фаз.
Література
1. Батенков В.А. Электрохимия полупроводников: учеб. пособие / В.А. Батенков. – [2-е изд.,
допол.], – Барнаул: Изд-во Алт. ун-та,
2002. – 162 с.
2. Хомченко Г.П. Окислительно-восстановительные
реакции / Г.П. Хомченко К.И.
Севастьянова. – К.: Просвещение, 1989. –
141 с.
3. Дамаскин
Б.Б. Химия / Б.Б.Дамаскин, О.А.Петрий, Г.А.Цирли — М.: Колос С, 2006. —672 с.
4. Плэмбек Дж. Электрохимические
методы анализа / Дж. Плэмбек. – М.: Мир, 1985. — 496 c.
5. Costas C. Modern Aspects of
Electrochemistry / C. Costas, G. Vayenas, Ralph E. White, Maria E. Gamboa-Aldeco. – Springer,
2008 – 420 р.
6. Гуртов,
В. А.Твердотельная электроника: Учеб. пособие / В. А. Гуртов. – Москва, 2005. –492
с.