Логвина А.О.,
Дитченко Т.И.
Белорусский государственный
университет, Беларусь
Изменение антирадикальной
активности
каллусов пажитника греческого при
варьировании концентрации экзогенной сахарозы
Пажитник греческий (Trigonella foenum-graecum L.) – известное
лекарственное растение, демонстрирующее
широкий спектр терапевтических эффектов, среди которых противораковое, антидиабетическое,
антисклеротическое, антианемическое, ранозаживляющее действие [1, 2]. Многочисленными
исследованиями показано, что экстракты, полученные из семян и надземной части
пажитника, эффективно нейтрализуют свободные радикалы, обуславливая многие его
фармакологические активности [3, 4, 5]. Выраженность антиоксидантных свойств Trigonella foenum-graecum создает предпосылки применения данного растения в
фармацевтической промышленности для получения антиоксидантных препаратов на его
основе.
Альтернативным способом получения антиоксидантного
комплекса Trigonella foenum-graecum в
промышленных масштабах может служить культура клеток in vitro. Перспективность широкого использования данной
технологии в будущем определяется преимуществами, которые может дать
производителям выращивание клеточных культур по сравнению с классическими
способами получения фитомассы. Наиболее значимыми из таких преимуществ являются
полная независимость культивирования от климатических условий и возможность
контролировать все этапы производственного процесса, что позволит решить
проблему дефицита исходного сырья для фармацевтической промышленности и
увеличить масштабы производства лекарственных препаратов. Направленность и
интенсивность биосинтетических процессов, а как следствие и возможные
проявляемые культурой клеток терапевтические эффекты, в значительной степени
определяются условиями культивирования [6].
В связи с этим
целью данной работы было изучение влияния сахарозы в различных концентрациях на
антирадикальную активность каллусных культур пажитника греческого.
Объектами исследования служили листовой и стеблевой
каллусы пажитника греческого озимой разновидности сорта PSZ.G.SZ. (далее ЛКОС и
СКОС соответственно) и листовой и стеблевой каллусы пажитника ярового сорта
Ovari 4 (далее ЛКЯС и СКЯС соответственно). Культивирование
каллусов осуществляли на вариантах питательных сред, состав которых был ранее
оптимизирован. Минеральная основа питательного раствора соответствовала среде
Мурасиге и Скуга (МС) [7]. Среды МС дополняли регуляторами роста
2,4-дихлорфеноксиуксусной кислотой, кинетином и индолил-3-уксусной кислотой.
Для приготовления плотной среды во всех экспериментах был использован агар в
концентрации 8 г/л. Величина рН питательных сред до автоклавирования составляла
5,7–5,8. Питательные среды стерилизовались путем автоклавирования при 0,5 атм и
130°С в течение 30–40 мин. Каллусные культуры выращивались в темноте в условиях
микробиологического термостата при температуре 24°С [8]. Исследование влияния
уровня сахарозы в среде на антирадикальную активность каллусов пажитника
греческого включало тестирование 4 вариантов сред, в которых содержание
углевода составляло 2, 3, 4 и 5%.
Антирадикальную активность каллусов
определяли методом DPPH (2,2-дифенил-1-пикрилгидразил). К 1 мл 0,3 мМ
свежеприготовленного спиртового раствора DPPH добавляли 2,5 мл 70%-го водно-спиртового экстракта.
Для приготовления нулевого раствора 1 мл 96% этанола смешивали с 2,5 мл 70%-го
этанола. Негативный контроль включал 1 мл 0,3 мМ раствор DPPH и 2,5 мл 70%-го этанола. Положительным контролем
служили пробы, включающие галловую кислоту, приготовленные аналогично способом.
Оптическую плотность раствора измеряли на спектрофотометре «Cary 50 Bio» при 520 нм через 4 часа после начала реакции. В ходе проведения
экспериментов пробы помещали в темноту. Антиоксидантный потенциал извлечений
оценивали по проценту ингибирования радикалов DPPH (I), рассчитываемому
по формуле I=((A-B)/A)*100, где А и В - оптические плотности негативного
контроля и исследуемого образца, соответственно [9].
Из представленных на рис. 1 данных видно, что взаимодействие
раствора DPPH с экстрактом ЛКОС,
культивируемого в присутствии 2% углевода, приводит к нейтрализации 48% молекул
радикала. Повышение содержания сахарозы сопровождается последовательным возрастанием
антирадикальной активности ЛКОС, так что наиболее высокий процент ингибирования
радикалов демонстрирует экстракт каллуса, выращиваемый на среде с 5% сахарозы (I – 77%). Та же закономерность наблюдается и в случае
СКЯС. Увеличение концентрации сахарозы в питательной среде с 2
до 5% приводит к росту процента дезактивированных экстрактом СКЯС молекул DPPH с 61 до 83%. При этом антирадикальная способность СКОС, культивируемого
в присутствии 2, 4 и 5% углевода, существенно не отличается от активности,
демонстрируемой ЛКОС. Тогда как добавление в состав среды 3% сахарозы приводит
к значительному повышению антирадикальной активности: процентное содержание
нейтрализованных радикалов в данном случае является равным по значению проценту
ингибирования DPPH, наблюдаемому при выращивании
данного каллуса на среде с 5% углевода (I – 81%). Антирадикальная же
активность, демонстрируемая ЛКЯС при его выращивании на среде с 2% сахарозы,
превышает таковую наблюдаемую у других тестируемых клеточных культур. Процент
ингибирования DPPH в данном случае составляет 73%. Повышение
концентрации экзогенной сахарозы до 4% приводит к усилению антирадикального
эффекта экстракта ЛКЯС – I составляет 84%. В результате
дальнейшего увеличения содержания сахарозы не наблюдается статистически
значимого роста определяемого показателя.
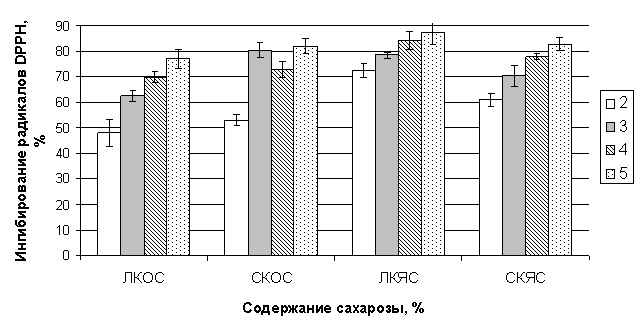
Рис. 1. Влияние концентрации сахарозы в питательной
среде на антирадикальную активность каллусных
культур пажитника греческого.
Таким образом, в ходе
проведенных исследований установлено, что антирадикальная активность каллусных
культур пажитника греческого увеличивается с повышением концентрации экзогенной
сахарозы. Наиболее низкий процент ингибирования радикалов наблюдается для
экстрактов всех исследуемых культур, выращиваемых на питательных средах,
дополненных всего 2% сахарозы. Во всех случаях антирадикальная активность
максимальна при культивировании каллусов на средах с относительно высоким (4 и
5%) содержанием сахарозы в среде, исключение составляет СКОС, демонстрирующий
одинаково высокую активность при его культивировании в присутствии как 3, так и
5% углевода. Причем максимальные значения процента ингибирования радикалов DPPH, характерные для всех тестируемых в данном
исследовании объектов, достоверно не различаются, варьируя в диапазоне 77-87%.
Известно, что сахароза, помимо того, что она
является источником углерода и энергии, необходимых для роста культур in vitro, способна оказывать сильное влияние на их
вторичный метаболизм [10, 11]. И поскольку выраженность антирадикальной активности
экстрактов опосредована биохимическим составом каллусных тканей, то, вероятно,
ее усиление, наблюдаемое при повышении концентрации экзогенной сахарозы,
вызвано стимуляцией биосинтеза веществ, обладающих антиоксидантными свойствами.
Среди вторичных метаболитов растений полифенолы являются одними
из наиболее активных антиоксидантов, эффективно дезактивирующих свободные
радикалы [12]. Для многих клеточных культур показано,
что увеличение концентрации экзогенной сахарозы в среде повышает их
биосинтетический потенциал в отношении данных соединений [13, 14, 15]. Возможно, стимулирующее
влияние повышенных концентраций сахарозы на биосинтез фенолов каллусами
объясняет их увеличивающуюся антирадикальную активность. В связи с этим,
необходимым является проведение анализа взаимосвязи между содержанием различных
групп фенольных соединений в каллусных культурах пажитника греческого,
культивируемых в присутствии сахарозы в различных концентрациях, и проявляемой
ими антирадикальной активностью, что и будет являться целью следующих этапов
исследований.
Литература:
1.
Chauhan G., Sharma M., Kharkwal H.,
Varma A. Pharmacognostic, preliminary phytochemical studies and anticancerous
potential of Trigonella foenum-graecum //
Pharma science monitor. 2011. Vol. 2 (2). P. 72–81.
2.
Yadav R., Kaushik R., Gupta D. The health benefits of Trigonella foenum-graecum: a rewiew //
International journal of engineering research and applications. 2011. Vol. 1 (1). P. 32–35.
3.
Kaviarasan S., Naik G.H., Gangabhagirathi R., Anuradha C.V.,
Priyadarsini K.I. In vitro studies on
antiradical and antioxidant activities of fenugreek (Trigonella foenum-graecum) seeds // Food Chemistry. 2007. Vol.
103. P. 31–37.
4.
Kaviarasan S., Viswanathan P.,
Anuradha C.V. Fenugreek seed (trigonella
foenum-graecum) polyphenols inhibit ethanol-induced collagen and lipid
accumulation in rat liver // Cell Biol Toxicol. 2007. Vol. 23. P. 373–380.
5.
Premanath R., Sudisha J., Lakshmi D.N., Aradhya S.M. Antibacterial and anti-oxidant
activities of fenugreek (Trigonella foenum graecum L.) Leaves // Research
Journal of Medicinal Plant. 2011. Vol. 5 (6). P. 695–705.
6.
Chawla H.S. Introduction to plant biotechnology (2nd ed.). Enfield:
Science Publishers. 2002. 538 p.
7.
Murashige T. Skoog F. A revised medium for rapid growth and bioassays
with tobacco tissue cultures // Physiol. Plant. 1968. Vol. 15 (13). P. 473–497.
8.
Endreb R. Plant cell biotechnology. Springer: Verlag
Berlin Heidelberg. 1994. 353 p.
9.
Martirosyan D.M. Functional foods for chronic diseases. Richardson:
D&A Inc. 2006. 256 p.
10. Ong S.L., Ling
A.P.K., Poospooragi R., Moosa S. Production of flavonoid compounds in cell
cultures of Ficus deltoidea as
influenced by medium composition // Int. J. Med. Arom. Plants. 2011. Vol. 1
(2). P. 62-74.
11.
Li
Y., Wang D.M., Jiang Z.M., Tang R. Effects
of basic media and culture conditions on growth of calluses and production of
secondary metabolites of Eucommia
ulmoides // Acta Botanica Boreali-occidentalia Sinica. 2004. Vol. 10.
P. 1–25
12. Rice-Evans,
C., Miller N.J., Paganga G.. Antioxidant properties of phenolic compounds //
Trends Plant Sci. 1997. Vol. 2. P. 152-159.
13. Bahorun T.,
Neergheen V.S, Aruoma O.I. Phytochemical constituents of Cassia fistula
// African Journal of Biotechnology. 2005. Vol. 4 (13). P. 1530-1540
14. Mervat M.M. El Far,
Hanan A.A. Taie. Antioxidant activities, total anthocyanins, phenolics and flavonoids
contents of some sweetpotato genotypes under stress of different concentrations
of sucrose and sorbitol // Australian Journal of Basic and Applied Sciences. 2009.
Vol. 3 (4). P. 3609-3616.
15.
, , ,
, Effect of osmotic pressure on paclitaxel
production in suspension cell cultures of Taxus
chinensis // Enzyme and Microbial Technology. 2001. Vol. 28 (2–3). P. 202–209.