Химия и химические
технологии. / Фундаментальные проблемы создания новых материалов и технологий.
К.х.н. Р.З.Шахназарли
Институт полимерных матераилов НАН
Азербайджана, Сумгайыт
ЦИКЛОПРОПАНСОДЕРЖАЩИЕ ФОТОЧУВСТВИТЕЛЬНЫЕ
РЕЗИСТЫ НА ОСНОВЕ МОДИФИЦИРОВАННОГО ПВС
Реферат: Синтезированы циклопропансодержащие
эфиры поливинилового спирта с различной степенью замещения гидроксильных групп.
Результатами спектрального и химического анализов установлена структура
полученных модификатов. Исследованы процессы термопревращений и фотоструктурирования
полученных полимеров. Показана возможность использования полученных модификатов
в качестве фоточувствительных полимеров при изготовлении фоторезистов.
Ключевые слова: этерификация, негативный фоторезист,
хлорангидрид винилокси (аллилоксиметил) циклопропанкарбоновой кислоты, фоточувствительность.
Введение
Фоточувствительные полимеры, благодаря
сочетанию таких ценных и специфических свойств, как термостойкость и
термопластичность, гибкость, прозрачность и пленкообразуемость, являются
перспективными материалами для использования их в самых различных областях
техники, в том числе и микроэлектроники. Одним из основных методов получения фоточувствительных
материалов является модификация известных полимеров путем введения в их макромолекулу
хромофорных групп, способных к фотохимическим превращениям [1]. Основное
преимущество этого метода заключается в
возможности получения на базе одного и того же полимера материалов с различной фоточувствительностью.
Из широко применяемых полимеров винилового
спирта и его производных большое значение в технике имеют поливиниловый спирт
(ПВС), его сложные и простые эфиры, в частности – поливинилциннаматы. В
литературе описаны примеры по использованию ПВС с боковыми ненасыщенными группами
для изготовления фоторезистов или фоточувствительных покрытий. Некоторые
производные ПВС, помимо фоточувствительности, обладают также антибактериальной
и иммуностимулирующей активностью, хорошей биосовместимостью и способностью к
биологическому разложению. ПВС, обладающий сильными гидрофильными свойствами,
был модифицирован виниловыми мономерами для получения сополимеров с улучшенными
свойствами [2]. Из литературных источников также известно, о проведении реакции
ацилирования ПВС различными насыщенными и ненасыщенными кислотами, ангидридами
и хлорангидридами карбоновых кислот [3].
При этом этерификация ПВС в условиях реакции Шоттена-Баумана [4] является
широко применяемым методом введения реакционноспособных функциональных групп, в
частности, алкенильных, в боковую цепь макромолекулы.
ПВС отличается высокой реакционной
способностью. Однако наличие межмолекулярной и внутримолекулярной водородной
связи в ПВС несколько затрудняет протекание реакции этерификации, что приводит
к падению скорости реакции модификации. Для уменьшения влияния водородной связи
на процесс модификации ПВС, реакцию ацилирования обычно проводят в растворе – в
смеси метилэтилкетона (МЭК) с толуолом [5]. В представленной работе мы осуществили
модификацию ПВС хлорангидридом винилокси- (1)
и аллилоксиметил- (2)
циклопропанкарбоновой кислоты и изучили процессы фотохимического и термического
структурирования полученных модификатов.
Результаты и
их обсуждение
Для сравнения полученных нами результатов в
статье также приведены данные, полученные ранее ацилированием ПВС коричной кислотой
[6].
Нами в качестве модификаторов для этерификации
ПВС были использованы хлорангидриды винилокси- (1) и аллилоксиметил- (2)
циклопропанкарбоновых кислот, полученные
из соответствующих сложных эфиров [7]:
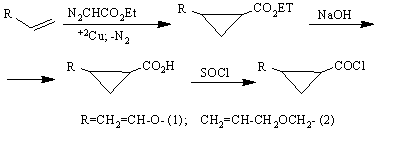
Процесс этерификации ПВС хлорангидридами 1 и 2 осуществляли в межфазных условиях по указанной ниже схеме:
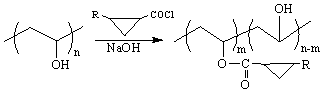
В результате реакции (изменением соотношения реагирующих компонентов и других
условий реакции) получили ацилированный в различной степени ПВС с боковыми функционально
активными группами. Мы исследовали влияние температуры, концентрации ПВС,
количества растворителя и продолжительности процесса на течение реакции и выход
целевых продуктов. Реакцию проводили при четырех температурных режимах (от –10
до +5 ºC) в широком
интервале времени (от 10 до 90 мин). Экспериментальные данные показали, что
увеличение продолжительности реакции от 10 до 90 минут приводит к повышению
выхода почти в 4 раза независимо от выбранного температурного режима. Полученные
данные приведены в таблице 1.
Таблица 1.
Значение
зависимости степени этерификации от продолжительности
при различных
температурах
|
Время, мин |
Степень этерификации, мол.% |
|||
|
–10°С |
–5°С |
0°С |
5°С |
|
|
10 |
24.0* / 21.5** |
30.0 / 24.5 |
24.5 / 21.0 |
20.0 / 19.5 |
|
20 |
49.5 / 43.5 |
55.5 / 49.5 |
47.0 / 43.0 |
28.5 / 31.0 |
|
30 |
61.0 / 57.5 |
75.0 / 72.0 |
60.0 / 58.5 |
56.0 / 48.5 |
|
60 |
84.0 / 78.5 |
90.0 / 85.5 |
85.5 / 80.5 |
82.5 / 68.5 |
|
90 |
86.5 / 83.0 |
91.5 / 89.0 |
87,0 / 85.0 |
80.5 / 71.5 |
* – в числителе – данные этерификации
хлорангидридом 1;
**
– в знаменателе – данные этерификации хлорангидридом 2.
Как следует из данных таблицы 1,
оптимальная температура проведения реакции этерификации ПВС –5°С.
Экспериментально выявлена зависимость
выхода от времени этерификации: установлено, что с повышением продолжительности
реакции выход увеличивается (табл.2). Результаты экспериментов показали, что по
истечении 60 мин скорость реакции этерификации несколько замедляется, что,
вероятно, связано с уменьшением концентрации
ПВС и хлорангидридов соответствующих кислот. В таблице 2 представлены
также данные зависимости степени этерификации от продолжительности реакции.
Таблица 2.
Влияние продолжительности
реакции этерификации на выход полимера
|
Время, мин |
Степень этерификации, мол. % |
Выход, % |
|
10 |
30.0* / 24.5** |
25 / 24 |
|
20 |
55.5 / 49.5 |
44 / 40 |
|
30 |
75.0 / 72.0 |
60 / 57 |
|
60 |
90.0 / 85.5 |
82 / 80 |
|
90 |
91.5 / 89.0 |
85 / 81 |
*
– для полимера, этерифицированного хлорангидридом 1;
**
– для полимера, этерифицированного хлорангидридом 2.
Варьированием реакционных
условий были получены этерифицированные
в различной степени полимеры, отличающиеся своими физико-химическими и
физико-механическими свойствами. В таблице 3 представлены некоторые данные для полученных
модификатов.
Таблица 3.
Свойства полимера с различной степенью этерификации
|
N |
Степень этерификации,% |
Tпл. |
[η], dl/g |
Выход, % |
|
1. |
30.0* / 24.5** |
130 / 121 |
0,099 / 0.104 |
25 / 24 |
|
2. |
55.5 / 49.5 |
132 / 123 |
0,093 / 0.101 |
44 / 40 |
|
3. |
75.0 / 72.0 |
136 / 129 |
0,089 / 0.096 |
60 / 57 |
|
4. |
90.0 / 85.5 |
143 / 135 |
0,078 / 0.088 |
82 / 80 |
*
– для полимера, этерифицированного хлорангидридом 1;
**
– для полимера, этерифицированного хлорангидридом 2.
Таким образом, экспериментально
установлены оптимальные условия получения эфиров ПВС: наибольший выход
этерифицированного ПВС достигается при концентрации ПВС 1.0 моль/л, водного
раствора гидроксида натрия 5.0 моль/л, содержании хлорангидрида в 200 мл
10%-ного раствора МЭК 1,2 моль/л, температуре реакции –5°С и продолжительности процесса – 1 час. Полученные
полимеры – белые порошки, проявляющие хорошую растворимость в различных
полярных (метилэтилкетоне, хлороформе, диоксане и др.) растворителях и
отсутствие растворимости в насыщенных углеводородах.
Из данных таблицы 3 следует, что с
повышением степени этерификации возрастает температура плавления, а характеристическая
вязкость этих полимеров падает.
Структура модифицированных ПВС установлена
методами элементного, спектрального (ИК и ПМР) и термогравиметрического анализов.
В ИК-спектрах этерифицированного ПВС проявляются полосы поглощения, характерные
для циклопропанового кольца (1020-1040 см-1 и 3060 см-1),
карбонильной группы (1720-1735 см-1) и простой эфирной связи (1080
см-1). В ПМР-спектрах этих полимеров имеются сигналы протонов,
характерные для следующих групп: СН2=СН– (d=4.35-5.45 м.д.); СН2– (d=1.5-1.75 м.д.); ОН– (d=3.64 м.д.); –C–O–CH– (1,05-1,26 м.д.); С=С–СН2О–
(4.0-3.93 м.д.) и циклопропановых протонов (d=0.75-2.10 м.д.).
Изучение процесса структурирования
полученных полимеров осуществляли воздействием на их пленки УФ облучения и температуры.
Термическая стабильность модификатов была
изучена термогравиметрическим анализом.
Обычно при нагревании ПВС и его производных (так же, как и при их облучении УФ
светом) протекают два параллельных процесса – распад макромолекулы и сшивание.
Термогравиметрические исследования показали, что модифицированный ПВС проявляет
лучшую термостабильность по сравнению с немодифицированным. Причем, с повышением
степени замещения увеличивается термическая стабильность модифицированных полимеров.
Это хорошо видно из данных, представленных в таблице 4. Было показано, что полученные
нами полимеры термически устойчивы до 220°С. Выше этой температуры происходят термопревращения,
в результате которых полимеры частично теряют растворимость. Начиная с 250°С, происходит интенсивное разложение этих полимеров.
Таблица 4.
Термогравиметрические показатели полимеров,
модифицированных соединением 1 (*) и 2 (**) в зависимости от степени
этерификации
|
TºC |
Степень этерификации, % |
Поливиниловый спирт |
|||
|
30* / 24.5** |
55.5 / 49.5 |
75 / 72 |
90 / 85.5 |
||
|
50 |
4.2 / 3.7 |
3.3 / 2.8 |
2.5 / 2.2 |
2.0 / 1.8 |
5.0 |
|
100 |
4.6 / 4.3 |
3.7 / 3.1 |
2.9 / 2.8 |
2.5 / 2.0 |
6.5 |
|
150 |
7.2 / 6.0 |
6.2 / 5.9 |
4.5 / 5.5 |
3.5 / 2.2 |
11,0 |
|
200 |
11.6 / 8.8 |
10.3 / 8.0 |
9.0 / 6.7 |
5.0 / 3.6 |
13,0 |
|
250 |
19.5 / 16.7 |
17.6/ 13.5 |
15.0 / 10.2 |
9.0 / 6.8 |
24,0 |
|
300 |
33.5 / 29.5 |
33.3 / 27.7 |
22.6 / 19.0 |
15.3 / 13.6 |
43,0 |
|
350 |
49.5 / 44.8 |
42.0 / 40.0 |
33.0 / 30.2 |
28.0 / 26.7 |
63,0 |
*
– полимер, этерифицированный хлорангидридом 1;
**
– полимер, этерифицированный хлорангидридом 2.
Был также изучен процесс
фотоструктурирования модифицированных полимеров путем облучения УФ светом пленок, нанесенных центрифугированием
на стеклянные подложки 10%-ного раствора модифицированного ПВС в МЭК (или ацетоне).
Показано, что при УФ-облучении этих пленок лампой ДРШ-250 в течение 15-180 мин
(расстояние от лампы до образца – 25 см) при комнатной температуре приводит к
потере растворимости пленок (рис.1).
![]()

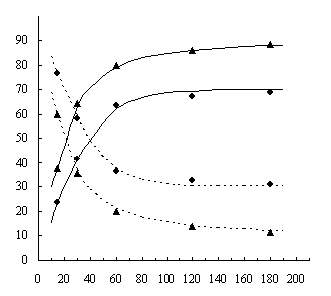
Рис. 1. Содержание (в %) нерастворимой (–––) и
растворимой (-----) частей полимера после облучения при 30%-ной и 90%-ной
степени замещения
После экстракции ацетоном растворимой
части образцов, облученных в течение 60 мин при температуре 50°С, по содержанию нерастворимого остатка определяли
степень сшивки. Полученные данные представлены в таблице 5.
Таблица 5.
Результаты
фотохимического структурирования полимерных пленок с различной степенью
этерификации
|
Степень этерификации полимера, % |
Время экспозиции полимера, мин |
Потери массы после облучения, % |
Нерастворимая фракция, % |
|
30.0 |
15 30 60 120 180 |
76.5 59.0 36.2 32.8 31.0 |
23.5 41.0 63.8 67.2 69.0 |
|
55.5 |
15 30 60 120 180 |
71.5 52.0 31.5 24.5 20.0 |
28.5 48.0 68.5 75.5 80.0 |
|
75.0 |
15 30 60 120 180 |
66.5 43.0 26.0 18.5 25.0 |
33.5 57.0 74.0 81.5 75.0 |
|
90.0 |
15 30 60 120 180 |
62.5 35.5 20.0 14.0 11.5 |
37.5 64.5 80.0 86.0 88.5 |
Фоточувствительность модифицированных
полимеров изучали сравнением ИК-спектров пленок, изготовленных из
модифицированных полимеров, до и после их облучения (рис. 2).
Спектральные исследования показали, что
происходит:
– уменьшение интенсивности полосы
поглощения алкенильных и циклопропановых групп при 1640 см-1 и 1040 см-1 соответственно;
– смещение полосы поглощения карбонильной
группы от 1720 к 1735 см-1 без изменения ее интенсивности;
– появление новой полосы поглощения при
700 см-1 (n С–Н);
– изменение интенсивностей полос поглощения при 1310, 1285, 980, 770 и 635
см-1;
– образование частичной сетчатой структуры
(появление нерастворимой фракции).
![]()
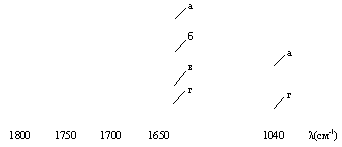
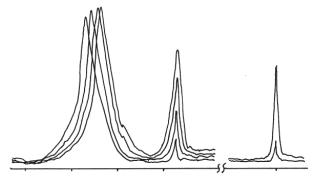
Рис. 2. Изменение
интенсивности полос поглощения в ИК-спектрах пленок в зависимости от времени
облучения a – (0), б – (10),
в – (20), г – (60 мин).
Наряду с УФ-облучением изготовленных
пленок, также рассматривали их поведение при воздействии на них высоких температур.
Установлено, что при нагревании их при 220°С в течение 24 часов в ИК-спектрах этих пленок заметных
изменений не наблюдается. Начиная с 240°С, в структуре этих пленок наблюдаются существенные изменения.
Для сравнения термостойкости модифицированных полимеров термическую деструкцию
проводили в атмосфере инертного газа при температуре 275°С. Через определенные промежутки времени путем
взвешивания образцов определяли потери
массы (в %) в полимерах со степенью этерификации ~50 % (рис.3). В ИК-спектрах термически обработанных или
облученных пленок наблюдается падение интенсивностей характерных полос
поглощения и появление новых. Изменение интенсивностей указанных полос
поглощения после УФ облучения пленок модифицированного ПВС показывает, что в
результате облучения (а также при нагревании) происходит образование
«мостиковых» связей за счет раскрытия алкенильных и циклопропановых групп и
потеря растворимости облученных участков пленок.
![]()

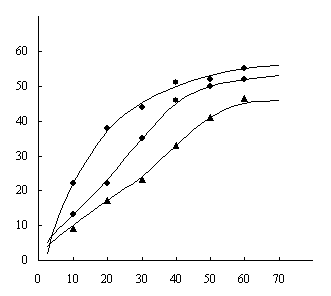
Рис. 3. Кривые зависимости
потери массы от времени в процессе термообработки ПВС, модифицированного
хлорангидридами 1 и 2
Полученные результаты также показывают,
что с увеличением степени замещения увеличивается скорость структурирования
модифицированного ПВС. При сравнении полимеров, содержащих в боковой цепи
макромолекулы винилокси- и аллилоксиметилциклопропановые группы, можно
заметить, что последние обладают более высокой активностью при сшивке, нежели
винилокси- замещенные, что, возможно, связано с участием в процессе сшивки,
наряду с двойными связями, и аллильных протонов. Все это позволяет предложить использование
этих полимеров в качестве фоточувствительных материалов для изготовления на их
основе фоторезистов.
Экспериментальная часть
ИК-спектры синтезированных соединений и
модификатов снимали на приборе "Specord"
M-80 в области призм KBr, NaCl и LiF в виде тонких пленок. ПМР-спектры снимали на
спектрометре BS-487 B фирмы "Tesla" (80 МГц) в растворе. Химсдвиги приведены в шкале d.
Характеристические вязкости модификатов
определяли в вискозиметре Оствальда. Термограммы модификатов снимали на
дериватографе (Паулик-Паулик-Эрдей) в атмосфере воздуха (скорость нагрева 5
град/мин). Фотоструктурирование полимеров проводили облучением
пленок, изготовленных из 10%-ного раствора в МЭК (или ацетоне).
Экспонирование проводили c помощью лампы ДРШ-250, расположенной на расстоянии 10-15 см
от образцов при температуре 20-23°С. Время экспозиции составляло 15-180 мин.
Облученные пленки выдерживали в растворителе (МЭК или ацетон) в течение 60 мин
при 50°С, после чего нерастворимую часть отделяли от растворимой.
Синтез
винилокси- и аллилоксиметилциклопропанкарбоновой кислот
0.1 моль этилового эфира соответствующей циклопропанкарбоновой
кислоты перемешивали с 0.4 моль
гидроксида калия в 60 мл абсолютного спирта при 60°С в течение 5 часов. После окончания реакции избыток
спирта перегоняли, в осадок добавляли воду и окисляли концентрированной соляной
кислотой. После отделения органического слоя водный слой неоднократно экстрагировали
этиловым эфиром и объединяли с органическим. После сушки над безводным
сульфатом натрия эфир отгоняли вначале над водяной баней, затем – в вакууме.
Синтез хлорангидридов винилокси- и аллилоксиметилциклопропанкарбоновой
кислот
К растворенному в петролейном эфире 0.1
моль соответствующей циклопропанкарбоновой кислоты приливали 0.24 моль
тионилхлорида. Температуру реакционной среды поддерживали на уровне 0°С. Смесь выдерживали в колбе с хлоркальциевой трубкой
в течение 24 часов, после чего удаляли петролейный эфир с помощью вакуума водяного
насоса. Остаток перегоняли в вакууме маслонасоса. Некоторые свойства
синтезированных циклопропанкарбоновых кислот и их хлорангидридов представлены в
таблице 6.
Таблица 6.
Некоторые
свойства циклопропанкарбоновых кислот и их хлорангидридов
|
Наименование соединения |
Ткип, °С/мм |
|
|
Выход, % |
Содержание*, % |
||
|
С |
Н |
Cl |
|||||
|
Винилоксициклопропанкарбоновая кислота |
107/10 |
1.4544 |
1.1167 |
98 |
63.3 |
5.3 |
– |
|
Аллилоксиметилциклопропанкарбоновая
кислота |
137/10 |
1.4707 |
1.1405 |
97 |
62.0 |
6.5 |
– |
|
Хлорангидрид винилоксициклопропанкарбоновой кислоты |
58/10 |
1.4590 |
1.1998 |
96 |
49.1 |
4.9 |
24.2 |
|
Хлорангидрид аллилоксиметилциклопропанкарбоновой кислоты |
101 /10 |
1.4749 |
1.2237 |
94 |
54.8 |
6.1 |
20.3 |
|
Хлорангидрид коричной кислоты |
257-260 |
– |
1.3082 |
91 |
64.8 |
4.2 |
9.6 |
* – экспериментально найденные
значения
Этерификация
ПВС хлорангидридами винилокси-, аллилоксиметилциклопропанкарбоновой и
коричной кислот
Этерификацию хлорангидридами
соответствующих циклопропанкарбоновых кислот проводили по методике, описанной в
[5]. ПВС растворяли в воде (концентрация 1
моль/л), добавляли 100 мл водного раствора NaOH (концентрацией 5 моль/л). Затем смесь охлаждали до –5°С и добавляли при постоянном перемешивании раствор
соответствующего хлорангидрида (концентрацией 1.2 моль/л) в смеси МЭК (90 мл) с
толуолом (10 мл). Образующееся на границе раздела двух фаз вещество
отделяли и промывали водой. Полученные
продукты сушили, растворяли в МЭК и высаживали в петролейный эфир, повторно сушили
в вакууме при комнатной температуре.
Выводы
Таким образом, наличие в боковой цепи
макромолекулы модификатов, полученных в результате этерификации ПВС
хлорангидридами винилокси- и аллилоксиметилциклопропанкарбоновых кислот,
кратной С=С-связи, циклопропанового кольца, а также карбонильной группы способствует
участию этих функциональных групп в процессах структурирования, что дает
возможность использовать эти модификаты в качестве фоторезистов негативного
типа.
Литература
1.
У.Моро. Микролитография:
принципы, методы, материалы. Пер. с англ. Часть 1. / М.: Мир, 1980, 606 с.
2.
N.Tudorachi, R.Lipsa. Copolymers based
on poly (vinyl alcohol) and acryl amide. // Journal of optoelectronics and
advanced materials. 2006. V. 8, № 2, p.659-662
3.
Bazilyuk T.N., Melnik N.P., Menjeres G. Modification of poly (vinyl alcohol)
by poly-N-vinylpyrrolydone. (transl. from Russian). // Chemistry’s and chemical
technology’s questions. 2003. № 1, p.57-60
4. Tsuda M. Schotten-baumann
esterification of poly(vinyl alcohol).I. // Macromol. Chem. 1964. V.72. p.
174-182
5.
Шахназарли Р.З., Гулиев
А.М. Этерификация поливинилового спирта и синтез фоточувствительных полимеров.
/ Сборник научных трудов «Химические реактивы, реагенты и процессы
малотоннажной химии», Минск 2013 г. (в печати)
6.
Белякова А.П., Боков Ю.С.,
Лаврищев В.П. и др. Светочувствительность поливинилциннамата и его
нитропроизводных. // Высокомолек. соед. 1965. т.7. № 9. с. 1637-1640
7.
Шахназарли
Р.З., Гасанова С.С., Гулиев А.М. Циклопропанирование дивинилового эфира
этоксикарбонил- и дихлоркарбенами и некоторые превращения полученных аддуктов.
// Азерб. Хим. Журнал. 2007. № 1. с. 51-54