Химия и химические
технологии/
6. Органическая химия
Д.х.н. Пурыгин П.П.,
асп. Юдахина Т.С.
Самарский
государственный университет, Россия
Исследование гидролитической
устойчивости имидозалидов 2-фталимидоэтансульфоновой кислоты
Одно из наиболее интенсивно развивающихся
направлений в медицине – создание фармакологических препаратов на основе производных
эндогенных метаболитов. В этом отношении несомненный интерес представляет
аминокислота таурин (2-аминоэтансульфоновая кислота).
В связи с
высокой фармакологической активностью таурина [1-4] учеными проводятся
интенсивные работы по созданию новых биологически активных веществ на основе
данной аминокислоты.
Нами был
осуществлен синтез не описанных ранее в литературе имидазолидов
2-фталимидоэтансульфоновой кислоты [5]: 2-имидазолид (I), 2‑метилимидазолид (II),
4-метилимидазолид (III), 2-изопропилимидазолид (IV), бензимидазолид (V):
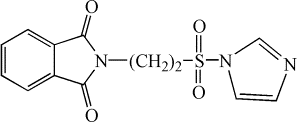
(I)
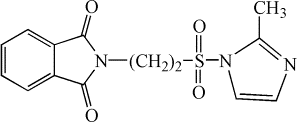
(II)
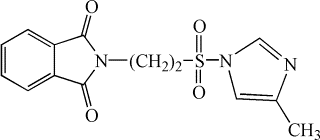
(III)
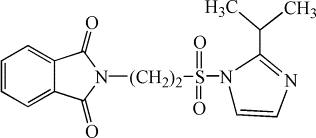
(IV)
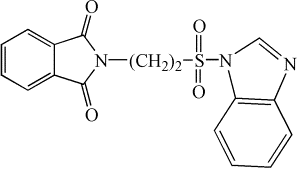
(V)
С целью определения реакционной
способности полученных соединений для
дальнейшего их использования провели исследование гидролиза имидазолидов.
Исследование кинетики
гидролиза гетероциклических производных осуществляли потенциометрически при
комнатной температуре с использованием потенциометра Hanna Instruments pH=11,
откалиброванного по стандартным буферным растворам. Применяли комбинированный стеклянный
электрод со встроенным электродом сравнения.
Для
исследования использовали растворы исследуемых веществ в системе ацетонитрил –
вода. Для приготовления смеси использовали бидистиллированную воду и ацетонитрил
марки ЧДА. Через равные промежутки времени (1 мин) измеряли рН раствора,
меняющегося во времени из-за выделения в результате гидролиза 2‑фталимидоэтансульфоновой
кислоты, количество которой эквивалентно количеству прореагировавшего
имидазолида.
При обработке результатов
изучения кинетики гидролиза расчет производили по кинетическому уравнению
псевдопервого порядка:
![]()
где k – константа скорости реакции, с-1; с – текущая концентрация реагента в момент времени t, моль/л; с0 –
концентрация реагента в момент времени t0, моль/л.
С учетом стехиометрии реакции гидролиза
можно записать уравнение для расчета константы скорости следующим образом:
![]()
Наряду с константой скорости
для характеристики скорости реакции гидролиза был рассчитан период полупревращения
(полураспада) по формуле:
![]()
Таблица 1
Результаты
изучения кинетики гидролиза
|
Соединение |
Концентрация, моль/л |
Константа скорости (k), с-1 |
Период полураспада (τ1/2),
ч |
|
(I) |
2∙10-3 |
1,74∙10-4 |
1,11 |
|
(II) |
2∙10-3 |
2,03∙10-4 |
0,95 |
|
(III) |
2∙10-3 |
1,77∙10-4 |
1,08 |
|
(IV) |
2∙10-3 |
2,20∙10-4 |
0,88 |
|
(V) |
2∙10-3 |
1,23∙10-4 |
1,56 |
Сравнение констант скорости гидролиза и
времени периода полураспада полученных соединений (таблица 1) показало, что
изменение реакционной способности полученных соединений может быть представлено
следующим рядом:
PhtNCH2CH2SO2-1-2-iPrIm (IV) >
PhtNCH2CH2SO2-1-2-MeIm (II) > PhtNCH2CH2SO2-1-4-MeIm
(III) > PhtNCH2CH2SO2-Im
(I) >>
PhtNCH2CH2SO2-1-BzIm (V)
Литература:
1. Gupta R.C., Win
and T., Bittner S. // Current Medicinal Chemistry. 2005. Vol.12. P. 2021–2039.
2. Walther M. // Comparative Biochemistry and
Physiology – Part A: Molecular&Integrative Physiology. 2002. Vol. 133.
Issue 1. P. 179–190.
3. Lim J.-G., Lee H.-Y., Yun J.-E., Kim S.-P. //
Biochemical Pharmacology. 2004. Vol 68, Issue 5.
P.901–910
4. Staab H.A.,
Bauer H., Schneider K.M. Azolides in Organic Synthesis and Biochemistry.
Weinheim, Germany, 2002. P.481–483.
5. Т.С. Юдахина, Ю.В. Морева, Ю.П. Зарубин, П.П. Пурыгин. // Журнал
органической химии. 2013. Т.49. Вып. 6.
С. 947-948.