Химия и химические технологии/6. Органическая химия
К.х.н.
Серикбаев Б.А.
Институт
органического катализа и электрохимии им. Д.В. Сокольского, Казахстан
ОБ АДСОРБЦИИ МОЛЕКУЛ
1,2,5-ТРИМЕТИЛПИПЕРИДИН-4-ОНА НА РТУТНОМ ЭЛЕКТРОДЕ
Электрохимические
процессы в полярографии органических соединений определяются не только
реакционной способностью молекулы, но и состоянием частиц в ДЭС, в
адсорбированном состоянии, степени деформированности в приэлектродном слое с
напряжением достигающим 106 – 107 В/см. Таким образом,
условия равновесия и кинетики реакций на поверхности электрода и в объеме
раствора неодинаковы [1]. Исследования, направленные на установление наличия
вышеперечисленных состояний может иметь существенное значение для однозначного
толкования электрохимических закономерностей с участием молекул 1,2,5-ТМП-4 в электродном процессе.
На рисунке-1
приведена полярограмма восстановления
1,2,5-ТМП-4 в интервале концентрации деполяризатора от 10-5 до 10-3 М при рH = 10, снятые на фоне 0,5М Na2SO4. Как видно из рисунка потенциал полуволны Е1/2
восстановления молекул 1,2,5–ТМП-4 равен
–1,75В относительно Н.К.Э.
Причем, в исследованной области изменения концентраций исходного
деполяризатора наблюдается прямая зависимость предельного тока (Jпр) от количества вводимого деполяризатора.
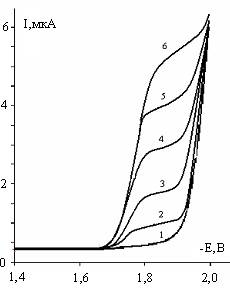
1-фон 0,5 М Na2SO4; 2–10-4 М; 3–2,5·10-4; 4 – 5·10-4 М;
5–7,5·10-4 М; 6–10-3 М;
Рисунок 1 Постояннотоковые полярограммы при различных концентрациях
1,2,5-триметилпиперидона-4, рН=10.
При значении
потенциала Е= -1,8 В построена зависимость предельных токов восстановления
молекул от концентраций 1,2,5-ТМП-4, которые приведены на рисунке-2. По
известной методике [2], рассчитано количество электронов, участвующих в
элементарном катодном акте молекул деполяризатора. Таким образом, установлено наличие двухэлектронного процесса
восстановления молекул 1,2,5-ТМП-4 при выбранном значении рН=10.
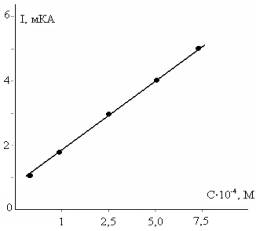
Рисунок 2 -
Зависимость предельного тока от концентрации 1,2,5-ТМП-4 при Е=-1,8 В
На рисунке-3 показана
зависимость емкости двойного электрического слоя РКЭ в зависимости от
количества вводимого в электролит 1,2,5-ТМП – 4 при рН=10. Как следует из этих
данных, значительное снижение емкости двойного слоя происходит при потенциалах
(-0,4 и - 0,8В), т.е. вблизи потенциала нулевого заряда ртутного электрода в
0,5 М Na2 SO4 [3]. Так
при концентрации 1,2,5-ТМП-4 равной 2,5·10-3моль/л в растворе
значение дифференциальной емкости составляет 9 мкФ/см2, затем
наблюдается подъем с размытым максимумом при Е=-1,1В и вновь спад до 17 мкф/см2,
сохраняющийся вплоть до потенциала -1,55В.
Природа максимума при значении потенциала -1,1 В по-видимому, связана с
частичной десорбцией молекул органического вещества. Нельзя исключить и
возможность протекания процесса переориентации молекулы 1,2,5-ТМП-4 на
поверхности ртутного электрода, вследствие его поляризаций. В пользу данного
рассуждения говорит и размытая форма максимума и строение исходной молекулы.
Известно, что молекула 1,2,5-ТМП-4 существует в виде кресла и ванны [4,5], и в
его поляризованном состоянии эти формы могут переходить в более удобное
состояние, которая и определяет особенность емкостных данных. О возможности
переориентации молекул анилина и пиридина в случае их адсорбции на ртути
говорится в работе Б.Б. Дамаскина [6].
В пользу природы пиков десорбции при -1,1В говорит факт отсутствия волны
восстановления на переменнотоковых полярограммах, снятых при этих же условиях,
а соответствующее значение ёмкости десорбции лежит значительно выше
дифференциальной емкости фонового раствора. Волны восстановления, высота
которых находятся в пропорциональной зависимости от объемной концентрации
1,2,5-ТМП-4 проявляются при потенциале -1,65В, что хорошо совпадает с
потенциалом пика псевдоемкости на С, Е – кривых. На основе анализа С,Е -
кривых, можно считать установленным, что максимальная адсорбция 1,2,5-ТМП -
4 происходит вблизи точки нулевого
заряда (Е=-0,5 В), однако наблюдающееся
минимальное значение емкости, видимо нельзя
объяснить обычной полислойной адсорбцией, так как в последнем случае
отмечалось бы снижение дифференциальной
емкости до величин 1-2 мкФ/см2 [6]. В пользу природы данных
максимумов говорит факт отсутствия волн на постояннотоковых полярограммах, что
хорошо согласуется с литературными данными для подобных процессов [6]. Значение
потенциала, при котором наблюдается максимум псевдоемкости, соответствующий
протеканию фарадеевского процесса, хорошо подтверждаются результатами
классической полярографии (рис.I).
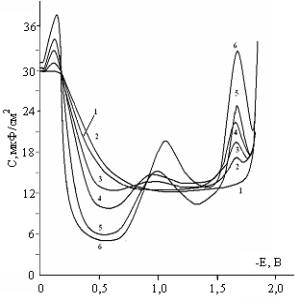
Обозначения кривых: 1 –
фон 0,5 М Na2SO4; 2 – 10-5М; 3 –10-4М; 4 –
2,5·10-4М; 5 – 5·10-4М; 6 – 10-3 М; рН=10
Рисунок-3. Кривые
дифференциальной емкости, снятые при различных концентрациях
1,2,5-триметипиперидона-4
На основании
вышеизложенных, можно считать установленными области потенциалов максимальной
адсорбции адсорбата (Е = - 0,5 В). На основе рассматриваемых С, Е – кривых
рассчитаны величины степени заполнения поверхности электрода от концентрации.
(рисунок-4), которая подчиняется
изотерме Фрумкина [1].
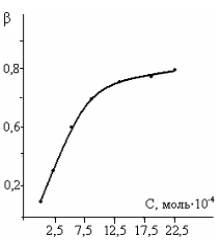
Рисунок 4 Изотерма адсорбции при потенциале максимальной адсорбции в
0,5 М Na2SO4, рН=10, Е = -0,65 В
На рисунке-5
приведены переменнотоковые полярограммы при различных концентрациях 1,2,5-ТМП -
4 , снятые при тех условиях, что и
классическая полярограмма и зависимость емкости от потенциала, которые
рассмотрены выше. Как следует из рисунка, в области катодных потенциалов
-1,7÷ -1,8 В при рН=10 имеется волна с максимумом предельного тока (IПР.), величина которой растет с ростом концентрации 1,2,5-ТМП – 4.
Значения потенциалов восстановления, полученные методом классической
полярографии и переменнотоковой полярографии, а также их хорошая корреляция со
значениями потенциалов псевдоемкости однозначно указывает на катодное
восстановление 1,2,5-ТМП – 4, при выбранных условиях полярографирования.
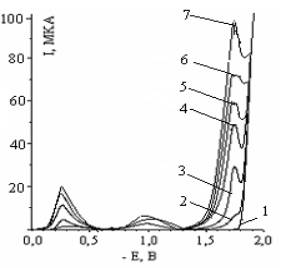
Обозначения кривых: 1 –
фон 0,5 М Na2SO4; 2 – 10-5М; 3 –10-4М; 4 –
2,5·10-4М; 5 – 5·10-4М; 6 – 7,5·10-4М; 7 - 10-3
М; рН=10
Рисунок 5 –
Переменнотоковые полярограммы 1,2,5-триметипиперидона-4
Аналогичные
исследования поведения 1,2,5-триметипиперидона-4 в растворе фона 0,5 М Na2SO4 проводились и при других значениях рН среды.
Всестороннее изучение поведения γ – пиперидонов при различных условиях
изменения параметров направлено на поиск условии осуществления эффективного
электрохимического метода получения вторичных спиртов на их основе. Кроме того,
изучение кинетики протонизаций и механизм электрохимического восстановления
1,2,5-триметипиперидона-4 в зависимости от рН – среды, когда она протекает под
действием одного донора протонов – гидратированного иона водорода упрощает
толкование результатов [8].
На
следующем рисунке-6 показаны полярограммы восстановления молекул
1,2,5-триметипиперидона-4 при рН=7, снятые
классическим способом. Во всей области изменения концентрации
1,2,5-ТМП-4 наблюдается одна волна его
восстановления, которая находится в симбатной зависимости от количества
введенного в раствор деполяризатора. Отличие от полученной полярографической
зависимости для рН=10 (рисунок-1), для рН=7 при регистрации полярограммы в
области его проявления наблюдалась заметная осцилляция тока, появляющиеся из-за
периодического роста и отрыва ртутной капли. Для устранения данного явления
зачастую приходилось использовать высокое демпфирование при снятии полярограмм,
что могли повлиять на значения предельного тока и потенциалов полуволны
восстановления. Возможной причиной возникновения осцилляции тока при рН=7 может
явиться и изменения, происходящие на поверхности капли, связанные с адсорбцией
продуктов реакций или же с наложением конкурирующих реакций. На возможное
протекание других реакций может ответить использование переменного тока в
исследованиях и применение буферных растворов для изменения кислотности
раствора.
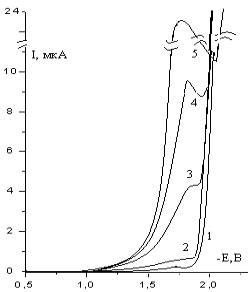
Обозначение кривых: 1-фон 0,5 М Na2SO4; 2 – 10-4 М; 3 – 5·10-4;
4 –10-3 М; 5 – 2,5·10-3 М; рН=7.
Рисунок 6 - Постояннотоковые полярограммы при различных концентрациях
1,2,5-триметилпиперидона-4:
На
рисунке - 7 показана зависимость емкости двойного электрического слоя РКЭ в
зависимости от количества вводимого в электролит 1,2,5-ТМП – 4 при рН=7. Как
следует из этих данных, значительное снижение емкости двойного слоя происходит
при потенциалах (-0,5 и -1,3В), т.е. в области потенциалов, соответствующие
отрицательно заряженной поверхности
ртути в Na2SO4. Такое
смещение потенциала адсорбции молекул 1,2,5-ТМП – 4 показывает насколько,
прежде всего рН раствора оказывает влияние на природу адсорбирующихся частиц,
на кинетику и механизм электрохимического восстановления деполяризатора, в
частности. Из полученных емкостных зависимостей (рисунок-7) видно, что в
области потенциалов Е=-1,1В, при котором на рисунке -3 для С – Е
зависимостей наблюдавшийся
десорбционный пик отсутствует. Из этого следует, возможное проявление адсорбционных явлений на
регистрируемых сигналах в переменнотоковых условиях. В подтверждение этому, на
кривых дифференциальной емкости от потенциала при значениях концентрации
1,2,5-ТМП – 4 в растворе происходит четкое разделение волны восстановления
молекул деполяризатора. Значения катодных потенциалов максимума отличается
приблизительно на 200 мВ. Причем, волна фарадеевской псевдоемкости при
умеренной концентрации 1,2,5-ТМП – 4 (2,5·10-3 М) максимум при
Е=-1,45В сопровождается глубоким спадом до значении двойнослойной емкости с
переходом во второй максимум с меньшими значениями псевдоемкости. Такой факт,
скорее всего, связан из-за эффекта больших заполнений, которые обсуждены в
работах Майрановского С.Г. и его сотрудников [ ]. По-видимому, имеет место
образования полислоя адсорбированных молекул, вызывающий эффект заполнения
поверхности, что в конечном счете приводит к торможению второй реакции, но с
меньшим значением псевдоемкости.
Для
однозначного интерпретирования экспериментов было сделано сравнение полученных
данных при одинаковых условиях с тремя
независимыми методами исследований. Далее рассмотрим закономерности,
полученные в условиях переменнотокового полярографирования.
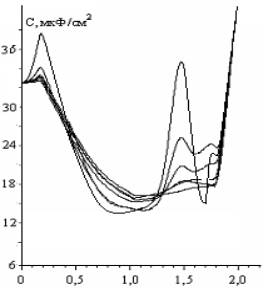
Обозначение кривых: 1-фон 0,5 М Na2SO4; 2 – 10-4 М; 3 – 5·10-4;
4 –10-3 М; 5 – 2,5·10-3 М; рН=7.
Рисунок 7-
Зависимость С,мкФ/см2 – Е при различных концентрациях 1,2,5-ТМП-4
Полярографические
зависимости, полученные при различных значениях концентрации 1,2,5-ТМП-4, при
рН = 7 в условиях наложения переменного тока представлены на рисунке – 8. Как и
ожидалось, переменнотоковые полярограммы в информативном аспекте оказались
очень удобным методом для установления механизма электрохимического
восстановления молекул деполяризатора. В исследованных областях изменения
концентрации 1,2,5-ТМП-4 в растворе имеет место, четко разделенных двух пиков,
соответственно при потенциалах для 1-ой волны Е1=-1,45В, для 2-ой
волны Е2 = - 1,75В. Причем, заметна
определенная закономерность в зависимостях Iпр. и Е1/2
от концентрации 1,2,5-ТМП-4 при данном значении рН=7. Так, высоты пиков
для обеих волн увеличиваются пропорционально концентрации деполяризатора.
Потенциал полуволны восстановления 1-ой волны не зависит от концентрации, а Е1/2
для второй волны сдвигается в отрицательную сторону от количества вводимого в
раствор γ-пиперидона.
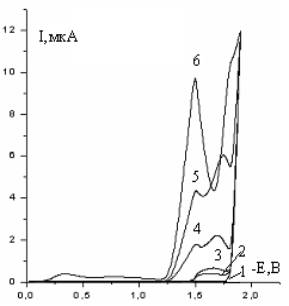
Обозначение кривых: 1-фон 0,5 М Na2SO4; 2 – 10-4 М; 3 – 5·10-4;
4 –10-3 М; 5 – 2,5·10-3 М; рН=7.
Рисунок 8 -
Переменнотоковые полярограммы при различных концентрациях 1,2,5-ТМП-4
Аналогичные
зависимости получены и для других значений рН = 3; 5; 8; 9, чтобы охватить всю
возможную область изменения параметра, оказывающего на сложный механизм
электрохимического восстановления, не в меньшей степени сложной молекулы
1,2,5-триметилпиперидин-4-она.
На
рисунках -9, 10 и 11 приведены результаты полярографических измерений,
полученные при различных значениях концентраций 1,2,5-ТМП-4 для рН = 5.
Рисунок-9, где показан, снятый классическим способом полярограмма от
концентрации органического деполяризатора при рН=5 в 0,5 М Na2SO4 характеризуются наличием 2-х волн восстановления
молекул 1,2,5-ТМП-4. Первая волна имеет потенциал полуволны в области Е=
-1,4÷ -1,5 В, а второй волне соответствует Е= -1,7 ÷ -1,8 В.
Высота 1-ой волны практически не изменяется от концентрации деполяризатора, а
второй увеличивается пропорционально количеству вводимого в раствор
1,2,5-ТМП-4. Такой характер зависимостей показывает на различный механизм
электрохимических процессов, протекающих на электроде при рН=5. Интересные
изменения имеет место на зависимостях емкостных измерений.
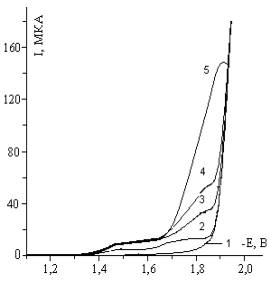
Обозначение кривых: С=0; 10-4;
2,510-4; 510-4; 10-3
Рисунок 9 - Кривые зависимости
1,2,5-ТМП-4 при рН=5 от концентрации
На рисунке-10
представлены зависимости С,мкФ\см2 от потенциала, полученные при тех
же условиях эксперимента, что и классические полярограммы (рисунок-9). Как
следует из экспериментальных данных, в области адсорбции нейтральных молекул,
при которых наблюдались минимумом дифференциальной емкости в области потенциала
нулевого заряда (Е = -0,5В), практически отсутствует явление адсорбции.
Адсорбционные минимумы смещены в область отрицательных потенциалов (Е ~ -1,5В).
Эти данные, прежде всего, свидетельствуют о тех изменениях в ДЭС, которые
обусловлены природой адсорбирующихся частиц на электроде. Известно, что
молекулы γ-пиперидонов в воде находятся в протонированной форме, и в
зависимости от рН-среды соотношение основной о протонированной формы изменяются.
В кислых растворах можно ожидать адсорбцию молекулы протонированной формы,
которые могут проявляться в отрицательной области потенциалов. По-видимому, это
явление имеет место при исследуемых условиях эксперимента. Нельзя, также
исключить влияние конформационной особенности молекулы, которая также зависит
от рН среды [9]. Таким образом, заслуживающего внимания фактом является
заметное снижение дифференциальной емкости с характерным минимумом адсорбции
молекул 1,2,5-ТМП-4 при отрицательных потенциалах (Е ~ -1,5). Из рисунка-10
видно некоторое смещение минимума емкости в отрицательную сторону значений катодного потенциала с
ростом концентрации исходного γ-пиперидона.
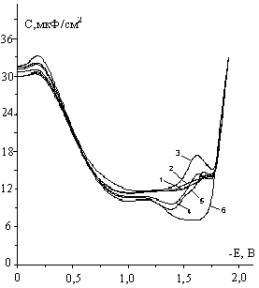
Обозначение
кривых: 1-фон, 0,5М Na2SO4; 2-10-4М
ТМП-4; 3-2,5·10-4 М ТМП-4; 4-5·10-4 М ТМП-4; 5-10-3 М ТМП-4; 6-2,5·10-3 М ТМП-4
Рисунок 10
- Зависимость дифференциальной емкости от потенциала при различной концентрации
1,2,5-ТМП-4, рН=5
Дальнейшие исследования
проводились методом снятия полярограмм с наложением переменного тока. Как следует из полученных данных (рисунок-11)
на полярограммах наблюдается два пика восстановления молекул 1,2,5-ТМП-4, которые подтверждают
рассмотренные выше на странице -
обсуждения для рисунка-9. Более четко выделенные волны восстановления
деполяризатора на переменнотоковых полярограммах хорошо дополняет полученные
данные другими методами.
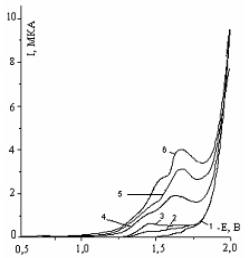
Обозначение
кривых: 1-фон, 0,5М Na2SO4; 2-10-4М
ТМП-4; 3-2,5·10-4 М ТМП-4; 4-5·10-4 М ТМП-4; 5-10-3 М ТМП-4; 6-2,5·10-3 М ТМП-4
Рисунок
11 – Переменнотоковые полярограммы 1,2,5-ТМП-4 при различных значениях
концентрации 1,2,5-ТМП-4, рН=5
Результаты
классического полярографирования при СТМП=10-2М от
значения рН раствора в интервале от рН=3 до рН=6 показаны на рисунке 12. На
кривых полученных при рН=3 и рН=3,5 наблюдаются две волны. Первой волне
соответствует Е1/2 = -1,4В, а для второй волны Е1/2 =
-1,8В. Первая волна уменьшаясь от рН, при значении рН=4 исчезает вовсе. Вторая
волна с повышением рН также уменьшается до значения рН=5, а при рН=6
наблюдается некоторое увеличение значения предельного тока. Из
экспериментальных данных также следует некоторое смещение потенциала
восстановления деполяризатора во второй волне в катодную область.
Литература:
1.
Майрановский С.Г. Каталитичекие и кинетические волны в полярографии // М.:
Наука, 1966. с. 288
2.
Бонд А.М. Полярографические методы в аналитической химии, - М., 1983, 328 с.
3.
Дамаскин Б.Б. Теория адсорбции органических соединений. // В кн. Успехи
электрохимии органических соединений. Изд. «Наука», М.: 1966. С.5-22.
4. 1. Простаков Н.С., Гайворонская Л.А.
γ-Пиперидоны в органическом синтезе, // Успехи химии. 1978. Т. ХLVII, № 5. С.859-899.
5. Назаров И.Н., Руденко В.А. Производные ацетилена.
Сообщение 84. Синтез и исследование гетероциклических соединений. V. Действие аммиака и метиламина на винилаллилкетоны.
Новый метод синтеза γ-пиперидонов
// Изв. АНСССР. Отд. хим. наук. – 1948. - № 6. – С. 610-618.
6.
Дамаскин . Б.Б. и др. ЖФХ, 38, 1797 (1964)
7. Майрановский С.Г. Кинетика протонизации и механизм
электрохимического восстановления ароматических альдегидов и кетонов в кислой
среде - Электрохимия. 1983, №6. С.-
838-841.
9 Розанцев Э.Г., Шолле В.Д. Органическая химия
свободных радикалов. М.: Химия. 1979. с. 343.
10. Майрановский
С.Г. Реакции электровосстановления органических веществ в присутствии
катализаторов, вызывающих каталитическое выделение водорода и электросинтез
хиральных соединений. // Успехи химии. 1991, Т.60. В. 10. – С. 2113 – 2142.