К.хим.
наук Воропай Л.М., к. техн. наук Мальцева С.Б.,
к. биол. наук Тихановская Г.А.
Вологодский
государственный университет, Россия
Тихонов
М.А.
ООО
«Александра-Плюс», г. Вологда, Россия
Влияние ультразвука
на окислительно-восстановительные процессы
Большой интерес с практической точки зрения представляют кавитационные явления в жидких средах. Известно, что ультразвуковые колебания вызывают в водных растворах как физические процессы, так и химические. Наиболее подробно изучены ультразвуковые явления диспергирования, эрозии твердых поверхностей, экстракции, растворимости [1]. Однако химические процессы, происходящие под действием ультразвуковых колебаний, до конца не исследованы. Известно, что ультразвуковые колебания вызывают изменения рН среды, температуры, могут вызывать процессы окисления [2].
В аналитической практике находит широкое применение сульфат железа (II), который используется в качестве восстановителя при потенциометрическом титровании раствором перманганата калия. Если погрузить инертный электрод в раствор, содержащий ионы двух- и трехвалентного железа, которые находятся в состоянии равновесия Fe2+↔Fe3+, то на электроде возникает потенциал, значение которого зависит от соотношения концентраций ионов Fe3+ и Fe2+. По мере прибавления к раствору сульфата железа (II) раствора перманганата калия содержание железа Fe2+ уменьшается, а содержание железа Fe3+ возрастает, соответственно возрастает и электродный потенциал. В точке эквивалентности все железо практически находится в форме Fe3+, а весь марганец в кислой среде – в форме Mn2+.
Известно, что ультразвук может вызывать окисление восстановленной формы железа (Fe2+→Fe3+) [2]. В связи с этим, в настоящей работе поставлена цель: исследовать влияние ультразвуковой кавитации на окислительно-восстановительные процессы, используя метод потенциометрического титрования.
Объектом исследования выбран водный раствор сульфата железа (II). Для выполнения эксперимента была смонтирована ультразвуковая установка контактного типа, которая состоит из пульта управления и ультразвукового реактора. Ультразвуковой реактор имеет следующие характеристики: напряжение питания – 220 В; частота переменного тока – 50 Гц; рабочая частота ультразвуковых колебаний – 22 кГц; количество излучателей – 2; мощность каждого излучателя – 0,1 кВт; объем ультразвуковой ванны – 2,5 л.
При выполнении потенциометрического титрования использовали потенциостат. С помощью кавитометра определялось число кавитации в зависимости от относительного расположения кавитометра по отношению к излучателям. Число кавитации колебалось от 300 до 700; при увеличении времени озвучивания число кавитации уменьшалось за счет увеличения вязкости обрабатываемых сред.
Экспериментальные данные свидетельствуют, что при увеличении времени озвучивания от 5 до 25 минут наблюдается рост температуры раствора от 302 до 352 К и более (рис. 1).
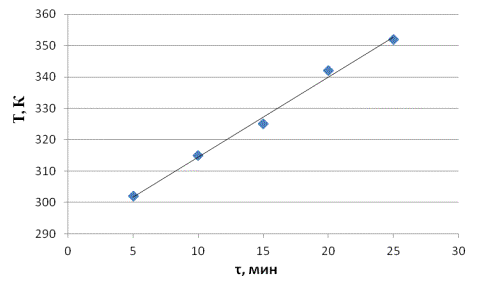
Рис. 1. Зависимость температуры раствора от времени озвучивания
Для определения влияния ультразвука на окислительно-восстановительные реакции были взяты 0,1 н раствор сульфата железа (II) и 0,1 н раствор перманганата калия.
Работу проводили по двум направлениям: определение характеристик потенциометрического титрования озвученного и неозвученного растворов сульфата железа (II).
В 2 стакана помещали исследуемые растворы сульфата железа (II), один раствор обрабатывали ультразвуком в течение 25 минут при числе кавитации 300 ÷ 700; при этом наблюдалось повышение температуры раствора до 80˚С. После охлаждения раствора до комнатной температуры проводили потенциометрическое титрование в кислой среде, добавляя раствор перманганата калия порциями по 5 мл. Параллельно по той же методике проводим потенциометрическое титрование неозвученного раствора сульфата железа (II).
Таблица 1
Результаты потенциометрического титрования
неозвученного раствора сульфата железа (II) перманганатом калия
|
№ |
Е, В |
V(KMnO4), мл |
Kа |
|
|
[Fe3+]/[Fe2+] |
|
1 |
0,675 |
0 |
47,66 |
1,51 |
1,491 |
1,09 |
|
2 |
0,679 |
5 |
47,94 |
1,483 |
1,4635 |
1,07019 |
|
3 |
0,689 |
10 |
48,65 |
1,4864 |
1,4665 |
1,07207 |
|
4 |
0,655 |
15 |
46,2496 |
1,4885 |
1,46885 |
1,07353 |
|
5 |
0,73 |
20 |
51,5453 |
1,48995 |
1,46975 |
1,0741 |
|
6 |
0,79 |
25 |
55,7819 |
1,4911 |
1,4705 |
1,074556 |
|
7 |
0,82 |
30 |
57,9002 |
1,4923 |
1,4715 |
1,0755176 |
|
8 |
0,95 |
35 |
67,079 |
1,49282 |
1,47127 |
1,075033 |
|
9 |
0,89 |
40 |
62,843 |
1,493504 |
1,47228 |
1,07566 |
|
10 |
0,85 |
45 |
60,0185 |
1,49411 |
1,47313 |
1,07618 |
|
11 |
0,79 |
50 |
55,7819 |
1,4965 |
1,47589 |
1,077885 |
На основании найденного значения
ЭДС (Е) рассчитывали значение электродных потенциалов окислителя (![]() ), восстановителя (
), восстановителя (![]() ), константы равновесия (Ка), а также изменение
соотношения концентраций [Fe3+]/[Fe2+].
Полученные данные представлены в таблицах 1 и 2. По изменению последнего
показателя определяли влияние ультразвука на окислительно-восстановительные процессы.
), константы равновесия (Ка), а также изменение
соотношения концентраций [Fe3+]/[Fe2+].
Полученные данные представлены в таблицах 1 и 2. По изменению последнего
показателя определяли влияние ультразвука на окислительно-восстановительные процессы.
Таблица 2
Результаты потенциометрического титрования озвученного
раствора сульфата железа (II)
перманганатом калия
|
№ |
Е, В |
V(KMnO4), мл |
Kа |
|
|
[Fe3+]/[Fe2+] |
|
1 |
0,692 |
0 |
48,862 |
- |
0,692 |
0 |
|
2 |
0,694 |
5 |
49,003 |
1,2384 |
1,216703 |
0,879167 |
|
3 |
0,697 |
10 |
49,21517 |
1,4864 |
1,4664 |
1,07204 |
|
4 |
0,725 |
15 |
51,19225 |
1,4885 |
1,46833 |
1,07321 |
|
5 |
0,76 |
20 |
53,6636 |
1,48995 |
1,46954 |
1,07396 |
|
6 |
0,83 |
25 |
58,6063 |
1,4911 |
1,470238 |
1,074394 |
|
7 |
0,91 |
30 |
64,255 |
1,4923 |
1,471 |
1,0754866 |
|
8 |
1,12 |
35 |
79,0832 |
1,49282 |
1,470423 |
1,074508 |
|
9 |
0,99 |
40 |
69,9039 |
1,493504 |
1,47174 |
1,07532 |
|
10 |
0,94 |
45 |
66,374 |
1,49411 |
1,47261 |
1,075863 |
|
11 |
0,89 |
50 |
62,8429 |
1,4965 |
1,47528 |
1,077510 |
Для получения результатов проводили следующие расчеты:
1) С учетом объема раствора перманганата калия, идущего на титрование, находили электродный потенциал окислителя по уравнению Нернста:
![]() = 1,51 +
= 1,51 + ![]() lg Cакт,
lg Cакт,
где 1,51В – стандартный электродный
потенциал системы ![]() ; Cакт – концентрация раствора
KMnO4.
; Cакт – концентрация раствора
KMnO4.
2) Рассчитывали константу равновесия:
Ka = exp ![]() ,
,
где n – число переданных электронов; F – постоянная Фарадея; Е – ЭДС; R – универсальная газовая постоянная; Т – температура, К.
3) Определяли значения электродного потенциала восстановителя по значению константы равновесия и электродного потенциала окислителя:
lg Kа =
![]() .
.
4) По значениям найденных электродных потенциалов находили изменения концентрации окисленных и восстановленных форм железа:
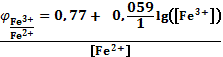
5) Для
определения окислительно-восстановительной активности RedOx-пар находили электронное давление ![]() – гипотетическую величину, связанную с активностью электронов, по
формуле:
– гипотетическую величину, связанную с активностью электронов, по
формуле:
![]() =
=![]() ,
,
где E – ЭДС; F - постоянная
Фарадея; R - универсальная газовая константа; T – абсолютная температура.
При этом
сильные окислители характеризуются низкими значениями ![]() , а сильные восстановители – высокими. Полученные данные
представлены в таблицах 3 и 4. Значение
, а сильные восстановители – высокими. Полученные данные
представлены в таблицах 3 и 4. Значение ![]() зависит также от
концентраций окисленных и восстановленных форм в системе.
зависит также от
концентраций окисленных и восстановленных форм в системе.
Таблица 3
Результаты
потенциометрического титрования без ультразвука
|
№ титр |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
12 |
|
V KMnO4, мл |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
E, В |
0.675 |
0.679 |
0.689 |
0.655 |
0.73 |
0.79 |
0.82 |
0.95 |
0.89 |
0.85 |
0.79 |
|
|
1.522 |
1.531 |
1.534 |
1.477 |
1.646 |
1.782 |
1.849 |
2.142 |
2.007 |
1.917 |
1.781 |
Таблица 4
Результаты
потенциометрического титрования с ультразвуком
|
№ титр |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
V KMnO4, мл |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
E, В |
0,692 |
0,694 |
0,697 |
0,725 |
0,76 |
0,83 |
0,91 |
1,12 |
0,99 |
0,94 |
0,89 |
|
|
1,422 |
1,448 |
1,464 |
1,547 |
1,637 |
1,811 |
2,018 |
2,5 |
2,217 |
2,12 |
2,007 |
|
T, К |
327 |
322 |
320 |
315 |
312 |
308 |
303 |
301 |
300 |
298 |
298 |
Таким образом, экспериментальные данные свидетельствуют о том, что предварительная ультразвуковая обработка раствора сульфата железа (II) вызывает изменения величин электродного потенциала системы, при этом концентрация восстановленной формы железа уменьшается, но наблюдается увеличение концентрации окисленной формы железа. Значения константы равновесия и электронной плотности для озвученных и неозвученных растворов сульфата железа (II) также свидетельствуют о том, что концентрация восстановленной формы Fe2+ в исходном состоянии для неозвученного раствора выше, чем в озвученном растворе.
Литература:
1. Акопян Б.В. Основы взаимодействия ультразвука с биологическими объектами: учебное пособие / Б.В. Акопян, Ю.А. Ершов; под ред. С.И. Щукина. – Москва: Издательство МГТУ им. Н.Э. Баумана, 2005.
2. Маргулис М.А. Звукохимические реакции и сонолюминесценция. – Москва: Химия, 1986.