Ветеринария / 1.
д.в.н. Анников В.В.1,
к.т.н. Родионов И.В.2, к.т.н. Бутовский К.Г.2,
асп. Фролова О.Н.1
Саратовский государственный аграрный
университет им. Н.И. Вавилова1
Саратовский государственный
технический университет2
Экспериментальное исследование остеокондуктивных свойств газотермических оксидных покрытий на чрескостных фиксаторах
Внешняя фиксация отломков трубчатых костей с использованием металлофиксаторов
(нержавеющие стали, сплавы титана, тантала, циркония) аппаратов остеосинтеза
является эффективным, малоинвазивным методом лечения больных с переломами и
другими костными патологиями как в гуманной, так и ветеринарной медицине (Г.А. Илизаров, 1974; Л.А. Анкин, 1985;
И.Б. Самошкин, 1989; О.В. Бейдик, 2002; В.В. Анников, 2006). В тоже время при
спицевой, а также стержневой чрескостной фиксации доля возникающих воспалительных
осложнений составляет существенную величину, что связано с ограниченными
остеоинтеграционными качествами поверхности фиксаторов. По данным А.А. Лебедева
расшатывание остеофиксаторов отмечалось в 60% от числа проведенных наблюдений,
в работе М.Е. Мюллера и др. указывается на появление осложнения вокруг
фиксаторов в виде остеопороза с последующим инфицированием имплантационой зоны
в 10-30% операционных случаев. Исследованиями Г.Д. Никитина отмечены явления
металлоза, пристержневого остеомиелита и образование кисты кости в 10%
операций, выполненных с применением чрескостных фиксаторов.
Одним из путей
решения данной проблемы является применение металлофиксаторов с биосовместимыми
керамическими покрытиями, способными обеспечить высокий уровень интеграции
поверхности с окружающими тканями. В качестве таких покрытий часто используются
кальцийфосфатные соединения, биостекло, биоситаллы, углеродные материалы,
однако методы их нанесения характеризуются повышенной технологической сложностью.
В последние годы развиваются исследования по разработке и созданию
оксидных покрытий на остеофиксаторах с целью придания им способности к
интеграции с биотканями и обеспечения высокой приживляемости [1,2]. Это связано
с тем, что многие известные биокерамические материалы для покрытий являются
дорогостоящими, не всегда доступны и требуют разработки специальных методов
синтеза. В данных условиях металлооксидные покрытия могут считаться
альтернативой широко распространенным кальцийфосфатным покрытиям и
характеризоваться более рациональным подходом при изготовлении чрескостных
фиксаторов с остеоинтеграционными качествами. Принципиальной особенностью при
этом является образование покрытия за счет химического или электрохимического
взаимодействия поверхностных слоев металла с окислительной технологической
средой без какого-либо нанесения дополнительных имплантационных материалов. Поэтому целью работы является
обоснование целесообразности применения оксидных покрытий на остеофиксаторах
путем исследования их основных качеств биосовместимости – коррозионной
стойкости и остеоинтеграционной способности.
Методика исследования
Опытные
остеофиксаторы представляли винтовые стержни из биотолерантной нержавеющей
стали 12Х18Н9Т (ГОСТ 5632-72), обладающей необходимой биомеханической
совместимостью. Стержни изготавливались путем токарной обработки и подвергались пескоструйной обдувке
поверхности для удаления загрязняющих слоев и создания исходной
микрошероховатости. Формирование оксидных покрытий проводилось в электропечи
сопротивления с использованием двух способов химико-термической обработки:
воздушно-термического и паротермического оксидирования.
При
воздушно-термическом оксидировании фиксаторов применялись воздушная атмосфера в
печи и температуры обработки 400, 500, 600, 7000С с
продолжительностью 0,5 ч при каждой температуре. Паротермическое оксидирование
выполнялось при температуре 5500С и выдержке 2 ч в атмосфере перегретого
водяного пара.
Коррозионное поведение
опытных фиксаторов изучалось путем моделирования их взаимодействия с
электролитом, имитирующим жидкую биосреду, при помощи специально подготовленной
лабораторной установки. Электролит представлял изотонический 0,9%-й раствор
хлористого натрия с величиной рН=7,4, отвечающий химическому составу плазмы
крови и тканевой жидкости. Оценка коррозионного поведения поверхности стальных
фиксаторов производилась по величине установившегося электродного потенциала Ес,
поскольку он характеризует термодинамическую устойчивость поверхности в
условиях протекания электрохимической коррозии.
Указанная методика
применялась для измерения потенциалов поверхности у трех опытных фиксаторов
каждой из следующих серий: 1 – токарная обработка; 2 – пескоструйная
обдувка; воздушно-термическое оксидирование при температурах: 3 – 4000С;
4 – 5000С; 5 – 6000С; 6 – 7000С;
7 – паротермическое оксидирование при температуре 5500С.
Потенциалы Ес
измерялись как до клинических испытаний остеофиксаторов с их установкой в кости
животным, так и после проведения клинических испытаний с удалением фиксаторов
из костей. Изменение потенциала и анализ вида поверхности фиксаторов после
клинических испытаний использовались для оценки их остеоинтеграционных качеств.
Клинические
испытания опытных фиксаторов проводились на кроликах 9-ти месячного возраста с
живой массой 4,5-5,0 кг, которые были
разделены на 7 опытных групп по 3 животных в каждой. Номер опытной группы
животных соответствовал номеру опытной
серии фиксаторов, полученных различными способами обработки. Клинические эксперименты
не противоречили Европейской биомедицинской этике и приказу МЗ СССР №755 от
12.08.1977г.
После
выполнения флексионного перелома
большой берцовой кости в области средней трети диафиза, в отломках
просверливались каналы для вворачивания фиксаторов. Учитывая, что прочностные
характеристики кости на разных участках ее длины имеют существенные отличия,
фиксаторы каждой опытной серии устанавливались как в метафизарные, так и в
диафизарные участки костей животных.
Фиксирующие
элементы вворачивались вручную с помощью рукоятки из комплекта аппарата Г.А.
Илизарова, после чего проводилась закрытая репозиция отломков. Их внешняя
фиксация выполнялась в аппарате, состоящем из кронштейнов и многодырчатой планки.
В постоперационный период всем животным проводилась превентивная антибиотиковая
терапия цефазолином, санация зоны контакта «фиксатор – кость» 3%-м раствором перекиси
водорода, а также выполнялись
клинические и гистологические исследования.
Клиническая оценка остеоинтеграционных качеств опытных фиксаторов проводилась путем выявления характеристик состояния животных, включающих регистрацию температуры организма, поведение животных, опороспособность конечности, микроподвижность фиксаторов, реакцию животных на прижатие фиксаторов, а также по уровню сопротивления вывертыванию фиксаторов.
После удаления фиксаторов из костей проводились
микроскопические исследования гистосрезов границы ткани с фиксатором в
гистоморфологических лабораториях Саратовского научно-исследовательского
института травматологии и ортопедии (СарНИИТО) и областной детской больницы г.
Саратова.
Результаты исследования и их анализ
В
течение первой недели после операции существенных отличий в состояние животных
всех опытных групп не отмечалось. У 7-ми животных регистрировалось повышение
температуры до 39,20С в течение 3-х суток, отказ от корма и воды
отмечался в течение 2-х суток у 12-ти животных. Опороспособность на оперированную
конечность наблюдалась уже на следующие сутки, которая в дальнейшем не нарушалась.
При локальном обследовании
всех животных отмечалась ярко выраженная картина воспаления в зоне «фиксатор –
кость» уже через сутки после операции, что проявлялось в виде отечности и
гиперемии мягких тканей, их болезненностью при пальпации. Однако не наблюдалась
микроподвижность фиксаторов и, как следствие, отсутствовало смещение отломков,
что свидетельствует о высоком качестве выполненной операции.
В первые четверо
суток у 8-ми животных была отмечена незначительная экссудация из-под
остеофиксаторов, которая прекратилась без дополнительных лечебных воздействий.
Данное явление может быть обусловлено мацерацией мягких тканей, возникающей при
вворачивании остеофиксаторов в кость.
По истечении первой
недели эксперимента клиническая картина, характеризующая состояние животных,
существенно изменилась, что связано с влиянием вида газотермического оксидного
покрытия фиксаторов и его свойств на окружающие биоструктуры.
У животных 3 и 4 групп
практически исчезли симптомы воспаления мягких тканей – гиперемия и отечность.
Пальпация тканей не вызывала беспокойства животных, микроподвижность фиксаторов
отсутствовала. Инфильтрация кожи на границе с фиксатором исчезла, что
обусловлено нормализацией гемодинамики в зоне контакта «фиксатор – кость» за
достаточно короткое время.
У кроликов 1, 2 и 7 групп
также отмечалась положительная динамика в состоянии мягких тканей на границе с
фиксаторами. Однако малозаметная отечность, слабая гиперемия и незначительная
экссудация из-под фиксаторов могут свидетельствовать о некотором раздражении
тканей в зоне контакта с поверхностью изделий, обработанных резцом, пескоструйной
обдувкой и паротермическим оксидированнием при температуре 5500С.
У животных 5 и 6 групп
при осмотре оперированных конечностей уже через трое суток после операции
отмечался значительный синюшный отек, болезненность мягких тканей с последующей
экссудацией, перешедшей затем в гнойную. При микроскопическом исследовании
отделяемого были обнаружены фрагменты металлооксидов из состава покрытий,
полученных путем воздушно-термического оксидирования при температурах 600 и 7000С.
Животные этих групп были вялые, сидели скученно, давление на фиксаторы вызывало
их беспокойство. Через неделю после операции пали двое животных 6 опытной группы
и одно животное 5 группы. Данные результаты свидетельствуют о низкой прочности
оксидного покрытия на фиксаторах, из-за чего произошло отделение его частиц,
развитие на металлической поверхности коррозионных процессов, инфицирование
ткани в зоне контакта с последующей гибелью животных.
Изменения состояния тканей вокруг фиксаторов, а также положения аппаратов
остеосинтеза на конечностях животных всех опытных групп, выявленные через месяц
после операции, связаны со свойствами поверхности фиксаторов, обработанных
различными способами.
Состояние животных 3 и 4 групп характеризовалось отсутствием воспалительных
реакций окружающих тканей и отделяемого
вокруг фиксаторов как в метафизарных, так и в диафизарных отделах кости. Общее
состояние животных было удовлетворительным, они охотно принимали корм и воду,
активно передвигались. Давление на аппарат остеосинтеза в целом и на каждый
фиксатор в отдельности не вызывали негативной реакции животных, что свидетельствовало
об отсутствии некроза и формировании костной мозоли.
У
животных остальных опытных групп к этому времени отмечалась экссудация из-под
фиксаторов, более заметная в метафизах, а у животных 5 группы она наблюдалась и
в диафизах. При этом небольшая подвижность аппаратов, регистрируемая как
пальпаторно, так и визуально, вызывала беспокойство животных.
Вышеуказанная тенденция сохранилась и на момент окончания эксперимента – по истечении 45 суток. Для извлечения фиксаторов из костей животных 3 и 4 групп было необходимым применение ключа. У животных 1, 2, 7 групп фиксаторы из диафизарных отделов вывертывались также ключом, из метафизов – вручную. Из костей животных 5 и 6 групп фиксаторы вывертывались вручную без значительного сопротивления.
Отсутствие
воспалительных осложнений у животных 3 и 4 групп в ранний постоперационный
период (7 суток), отсутствие микроподвижности фиксаторов в отдаленный период
(45 суток), необходимость применения ключа для вывертывания фиксаторов по
окончании эксперимента могут служить клиническим свидетельством наличия
остеоинтеграционных качеств у оксидных покрытий, полученных
воздушно-термической обработкой при температурах 400 и 5000С.
При исследовании
коррозионного поведения стальных чрескостных фиксаторов, обработанных
различными способами, установлено, что все значения коррозионных потенциалов Ес
поверхности находятся в отрицательной электродной области (табл.).
Однако наименьшими отрицательными значениями потенциала поверхности после
клинических испытаний, а значит повышенной коррозионной устойчивостью в жидких
биосредах, обладают фиксаторы с покрытием, полученным воздушно-термическим
оксидированием при температурах 400 и 5000С (серия 3, 4).
Таблица
Изменение коррозионного
потенциала стальных остеофиксаторов, обработанных различными способами, до и после 45 суток клинических испытаний
|
№ опытной серии |
Вид обработки поверхности |
Температура модельного раствора (0,9% NaCl.
рН=7,4), 0С |
||||||||||
|
25 |
30 |
35 |
40 |
45 |
||||||||
|
Потенциал поверхности Ес, В
(н.х.с.э) |
||||||||||||
|
до исп. |
после исп. |
до исп. |
после исп. |
до исп. |
после исп. |
до исп. |
после исп. |
до исп. |
после исп. |
|||
|
1 |
Подготовка |
Токарная |
-0,095 |
-0,161 |
-0,083 |
-0,159 |
-0,072 |
-0,160 |
-0,066 |
-0,162 |
-0,058 |
-0,159 |
|
2 |
Пескоструйная |
-0,085 |
-0,146 |
-0,076 |
-0,145 |
-0,066 |
-0,144 |
-0,054 |
-0,154 |
-0,042 |
-0,154 |
|
|
3 |
Воздушно-терм. оксидирование, τ = 0,5 ч, t, 0С |
400 |
-0,349 |
-0,092 |
-0,350 |
-0,103 |
-0,352 |
-0,108 |
-0,351 |
-0,109 |
-0,351 |
-0,107 |
|
4 |
500 |
-0,359 |
-0,103 |
-0,365 |
-0,104 |
-0,372 |
-0,099 |
-0,380 |
-0,086 |
-0,414 |
-0,078 |
|
|
5 |
600 |
-0,362 |
-0,152 |
-0,364 |
-0,152 |
-0,387 |
-0,158 |
-0,402 |
-0,154 |
-0,412 |
-0,167 |
|
|
6 |
700 |
-0,375 |
-0,196 |
-0,407 |
-0,152 |
-0,415 |
-0,130 |
-0,424 |
-0,151 |
-0,435 |
-0,133 |
|
|
7 |
Паротерм. оксидирование, t = 5500С, τ = 2 ч |
-0,343 |
-0,145 |
-0,339 |
-0,151 |
-0,335 |
-0,153 |
-0,333 |
-0,154 |
-0,332 |
-0,154 |
|
В целом, коррозионное поведение фиксаторов с газотермическими оксидными
покрытиями до и после клинических испытаний характеризуется смещением коррозионного
потенциала в более положительную
электродную область благодаря образованию на поверхности покрытий тонкой пленки
белковых структур, формирующейся при функционировании фиксаторов в организме и
повышающей их защитные свойства (табл.).
При исследовании
внешнего вида извлеченных остеофиксаторов было установлено, что фиксаторы без
оксидного покрытия не имеют на поверхности следов интеграционного
взаимодействия с костной тканью. Фиксаторы с покрытиями, полученными
воздушно-термическим оксидированием при 400 и 5000С, а также паротермическим
оксидированием при 5500С, содержат на поверхности фрагменты кости
различного размера, что свидетельствует о наличии у таких покрытий определенной
остеокондуктивности (рис.1.). Это связано с тем, что сформированные
воздушно-оксидные и парооксидные покрытия обладали поверхностной структурой,
физико-химическими и механическими свойствами, создавшими необходимые условия
для протекания их эффективной остеоинтеграции без появления ярко выраженных
иммунных реакций тканей. Оксидированные фиксаторы успешно адаптировались в
организме с образованием прочной взаимосвязи с окружающей костью, характеризовались
отсутствием подвижности и смещений при функционировании.

Рис.
1. Оксидированные остеофиксаторы из стали 12Х18Н9Т с фрагментами костной ткани
после клинического испытания: а, б – с покрытием, полученным воздушно-термическим оксидированием при t=400 и 5000С, τ =0,5 ч, соответственно
(серия 3, 4); в – с покрытием, полученным с
паротермическим оксидированием при t=5500С, τ =2,0 ч (серия 7)
Покрытия,
созданные воздушно-термическим оксидированием фиксаторов при температурах 500 и
6000С, не обеспечили интеграционного взаимодействия с окружающей костной
тканью, не проявили остеокондуктивной способности.
Данные клинического наблюдения и результаты проведенных коррозионных испытаний подтверждены гистологическими исследованиями костной ткани на границе с фиксаторами. В частности, при гистологических исследованиях костной ткани были выявлены следующие изменения: в образцах, полученных от животных 1 группы, кость была представлена компактной 1 и губчатой тканями, трабекулы значительно склерозированы, местами расширены; в зоне введения фиксатора отмечались очаги дегенерации кости, разрастание фиброзной ткани с наличием фибробластоподобных клеток, участки скопления остеобластов с умеренной пролиферацией, очаговое скопление лимфоцитов, а также плазмоцитов, что может свидетельствовать о подостром характере воспаления 2 (рис.2).

В образцах костей животных 2 группы костная ткань
была представлена губчатой и компактной структурами с умеренно
склерозированными трабекулами. В зоне введения фиксаторов было заметно наличие
очагов подострого воспаления, при этом отмечалось присутствие молодого
волокнистого хряща, что свидетельствует о формировании молодой костной ткани 1
(рис.3).

В образцах костей от 3 и 4 групп животных
выявлено наличие трабекул 1 губчатой костной ткани местами
склерозированых, но полнокровных. В месте введения остеофиксатора есть тонкая
фиброзная ткань 2 с фибробластами и остеобластами. Признаки воспаления
отсутствуют, имеется разрост соединительной
ткани, что является признаком начала протекания остеогенеза (рис.4).
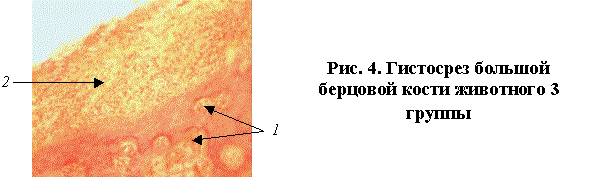
В образцах костей 5 и 6 группы
лабораторных животных губчатая костная ткань содержала умеренно склерозированные
полнокровные трабекулы 1 (рис.5). В зоне контакта с остеофиксатором
имелся разрост соединительной ткани с очагами подострого воспаления (лимфоциты,
сегментоядерные лейкоциты в небольшом количестве) 2, наблюдались дегенерация
и присутствие фрагмента молодого хряща.
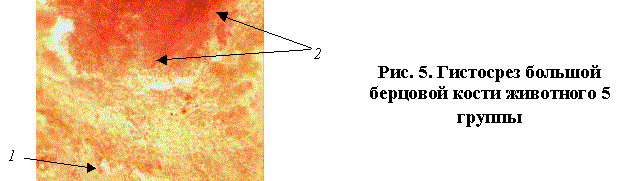
В образцах животных 7 группы отмечалось наличие губчатой костной ткани 1 с несколько расширенными и склерозированными трабекулами. На границе контакта с фиксатором имелся очаг фиброзной ткани 2 с очагово выраженной клеточной инфильтрацией, представленной, в основном, лимфоцитами и сегментоядерными лейкоцитами 3. Кроме того, наблюдались скопления остеобластов с умеренной пролифирацией, что свидетельствует о возникновении острого воспаления (рис.6).

Таким образом, результаты проведенных
исследований показывают, что необходимым уровнем биосовместимости и выраженной
остеоинтеграционной способностью обладают металлооксидные покрытия стальных
фиксаторов, созданные воздушно-термическим оксидированием при температурах 400
и 5000С с продолжительностью 0,5 ч. Данные покрытия проявили
наибольшую остеокондуктивность и повышенную коррозионную устойчивость при
клинических испытаниях.
Выводы
1. Выполненными
исследованиями доказана целесообразность применения чрескостных фиксаторов из
стали 12Х18Н9Т с оксидными покрытиями, полученными газотермическим
оксидированием.
2. Путем проведения гистологических
исследований установлено, что наличие в губчатой ткани гистосрезов
полнокровных, незначительно склерозированных трабекул, а на границе с
остеофиксатором молодой фиброзной ткани с присутствием большого количества
изобилующих фибро- и остеобластов, свидетельствует о высоком уровнем остеокондуктивных
свойств у покрытий стальных чрескостных фиксаторов, созданных
воздушно-термическим оксидированием при температурах 4000С, 5000С
и продолжительности 0,5 ч.
Литература
1. Родионов И.В., Бутовский К.Г.,
Анников В.В., Хапрова Т.С., Фролова О.Н. Биоинтеграционные качества
термооксидных покрытий чрескостных стержневых металлофиксаторов при клинических
испытаниях // Наукоемкие технологии. №8. Т.9, 2008. С. 57-66.
2.
Родионов И.В. Термооксидные покрытия остеофиксаторов из стали 12Х18Н9Т, полученные воздушно-термическим оксидированием //
Инженерная физика. №6, 2008. С. 56-64.