Е.В. Федорова, Е.В. Куваева, Г.М. Алексеева, Г.В Ксенофонтова
Санкт-Петербургская государственная химико-фармацевтическая академия. Кафедра
органической химии
КИСЛОТНЫЕ СВОЙСТВА
НЕКОТОРЫХ
4,6-ДИГИДРОКСИПИРИМИДИНОВ
Значение
полигидроксипиримидинов в химии лекарственных и физиологически активных
соединений, молекулярной биологии, фармакологии и фармации трудно переоценить.
Хорошо известны такие препараты как фторурацил, фторофур, зидовудин,
6-метилурацил и др. Особую группу лекарств составляют производные
гидроксипиримидинов, обладающих снотворным, обезболивающим действием,
проявляющих антиатеросклеротический, гипотензивный, антидиабетический эффекты [1-3].
Среди подобного рода соединений
производные 4,6-дигидроксипиримидинов остаются до сих пор мало изученными, а сведения, имеющиеся в
литературе, не систематизированы.
Целью
нашей работы стало получение ряда 4,6-дигидроксипиримидинов и изучение их
кислотных свойств, так как установлено, что если лекарственное вещество при
значениях рН, свойственных средам организма, находится главным образом в
неионизированном виде (т.е. в липофильной форме), оно лучше растворимо в
липидах, чем в воде и хорошо проникает через биологические мембраны. И
наоборот, если вещество ионизировано, оно плохо проникает через мембраны клеток
в различные органы и ткани, но обладает лучшей водорастворимостью [4].
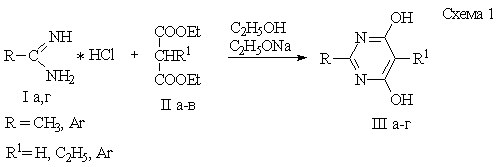
Синтез производных 4,6-дигидроксипиримидинов осуществляли, используя
в качестве исходных веществ гидрохлориды соответствующих амидинов и малонового
или замещенного малонового эфира. Конденсацию проводили в абсолютном этиловом
спирте в присутствии этилата натрия при перемешивании в течение 48 часов [5] (схема
1).
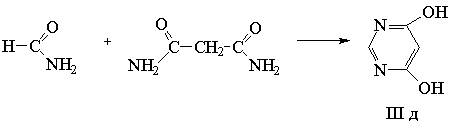
В результате конденсации формамида с
амидом малоновой кислоты был получен незамещенный 4,6-дигидроксипиримидин [6] (схема
2).
Схема 2
Для
характеристики кислотно-основных свойств полученных соединений нами впервые были определены константы
кислотной диссоциации всех синтезированных соединений методом
потенциометрического кислотно-основного титрования [7]. Для подтверждения
применимости метода была оттитрована барбитуровая кислота. Полученное
экспериментальным путем значение рКа совпало с литературными данными
(4,04-4,05).
Исследования проводили с 1÷5*10-3М
водно-спиртовыми растворами пиримидинов (III а-д) (5% этанола), которые титровали на фоне 0.03М
раствора нитрата калия (KNO3) 0.05М раствором гидроксида калия (КОН), не
содержащего карбонат калия (К2СО3). В качестве
индикаторного электрода использовали стеклянный электрод марки ЭЛС-43-07, в
качестве электрода сравнения хлорсеребряный ЭВЛ-1М3. Значения измеряли на
потенциометре рН-121 с точностью ±0,05 единиц рН при постоянной ионной силе. В
ходе эксперимента поддерживали температуру 250С с помощью
термостата.
Таблица 1
Константы ионизации
пиримидинов
|
№ |
R |
R1 |
pKa |
|
III а |
CH3 |
H |
6,63 |
|
III б |
CH3 |
CH3-CH2- |
6,65 |
|
III в |
CH3 |
Ar |
5,9 |
|
III г |
Ar |
H |
5,87 |
|
III д |
Н |
Н |
5,82 |
Судя по величине рКа (таблица
1) исследованные пиримидины (III а-д)
являются слабыми кислотами и зная значения рН биологических сред организма
можно сделать заключение, что данные соединения находятся в неионизированной
форме, должны легче проникать через клеточные мембраны.
Список литературы:
1.
Машковский М.Д.
Лекарственные средства. М.: Медицина. 1997. Т. 1. с. 25-32
2.
Дайсон Г., Мей П. Химия
синтетических лекарственных средств. Пер. с англ. М.: Мир. 1964. 660 с.
3.
Полковникова И.И. Синтез,
строение, свойства и биологическая активность продуктов конденсации
полигидроксипиримидинов с альдегидами. Автореф. дисс. … канд. хим. наук. СПб.
1997. 24 с.
4.
А.И. Кения, Ю.И.
Бандажевский. Здоровый человек: основные показатели. Минск: «Экоперспектива»,
1997. 108 с.
5.
Henze, Smart. Org. Chem//1952
6.
Ahmed F. Khattab, Erik B. Pedersen. NUCLEOIDES, NUCLEOTIDES &
NUCLEIC ACIDS // Vol. 22, No. 1, 2003
7.
Физические методы в
химии гетероциклических соединений. Под. ред.Катрицкого. М.-Л.: Химия 1966. 660
с.