Е.В. Куваева,
Е.В. Федорова, В.Ф Апраксин, И.П. Яковлев,
Т.Л.
Семакова
Санкт-Петербургская
государственная химико-фармацевтическая академия
Кафедра
органической химии
ИЗУЧЕНИЕ ОСНОВНЫХ
СВОЙСТВ N-АРИЛБЕНЗАМИДИНОВ
Амидины обладают высокой биологической активностью.
Амидиновый фрагмент (обычно в составе гетероцикла) входит в структуру многих
лекарственных препаратов, например, нафтизина, галазолина, фентоламина,
хлордиазепоксида. Амидиновые основания часто используются как антимикробные
средств. Тем не менее, физико-химические свойства этого интересного класса
соединений все еще остаются мало изученными. Это касается и их основности, хотя
известно, что многие амидин
гидросульфонаты используются в
химиотерапии, соли моно- или ди-N-замещенных
амидинов могут быть превращены в соли
других кислот [1-4].
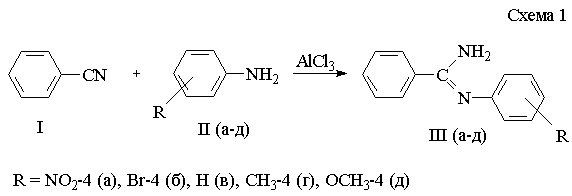
Поэтому целью нашей работы стало изучение рКа
N-арилбензамидинов (IIIа-д), которые были получены
взаимодействием замещенных анилинов с бензонитрилом в присутствии
катализатора безводного хлористого алюминия [5] (схема 1).
Нами были впервые определены константы
ионизации N-арилбензамидинов (III а-д). Основными методами определения констант
ионизации являются спектрофотометрия, кондуктометрия, спектрометрия ЯМР, метод
потенциометрического кислотно-основного титрования [6,7]. Последний метод относится
к числу наиболее удобных и быстрых.
Исследования проводили с 1÷5*10-3М
водно-спиртовыми растворами
N-арилбензамидинов (III а-д) (9,6% этанола), которые титровали на фоне 0.03М
раствора нитрата калия (KNO3) 0.05М раствором соляной кислоты (HCl). В качестве индикаторного электрода использовали
стеклянный электрод марки ЭЛС-43-07, в качестве электрода сравнения
хлорсеребряный ЭВЛ-1М3. Значения измеряли на потенциометре рН-121 с точностью
±0,05 единиц рН при постоянной ионной силе. В ходе эксперимента поддерживали
температуру 250С с помощью термостата.
Таблица 1
Константы ионизации N-арилбензамидинов (III а-д)
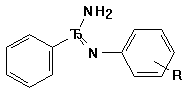
III а-д
|
№ |
R |
pKa |
|
III а |
NO2-4 |
6,38 |
|
III б |
Br-4 |
7,69 |
|
III в |
H |
9,01 |
|
III г |
CH3-4 |
9,17 |
|
III д |
OCH3-4 |
9,45 |
Полученные данные свидетельствуют, что основность
N-ариламидинов
(III а-д) (таблица 1) существенно зависит от электронной природы
заместителя R. Акцепторные заместители понижают основные свойства, а донорные
заместители, наоборот, повышают основные свойства N-арилбензамидинов, что говорит о достаточно развитой
системе сопряжения в этих структурах (таблица 1).
Величина рКа (таблица 1)
исследуемых N-арилбензамидинов (III а-д)
позволяет предсказать, как тот или иной амидин будет всасываться в кровь,
распределяться в органах и тканях. Так зная рН среды и рКа вещества
можно определить степень ионизации, а значит, степень его всасывания из
желудочно-кишечного тракта.
N-арилбензамидины (III а-б) в нашем случае проявляют слабые основные
свойства, поэтому при рН крови (7,37-7,43) и содержимого кишечника (5,0-6,0)
амидины находятся в основном в неионизированном виде (т.е. в
липофильной форме) в результате чего можно предположить, что они хорошо проникают через биологические
мембраны.
Список литературы:
1.
Frank Short, Peter Oxley. Protuction of amidines. Patent 2,433,489. Dec.
30, 1947.
2.
Fulton et al., Annals Tropical
Med. And Parasitology, vol. 36, pages 131 – 133 (1942).
3.
Shriner et al., Chem. Reviews,
vol. 35, No. 3, pages 360, 363, 373 (1944).
4.
Evans et al., Lancet, Oct. 21,
1944, pages 523, 524.
5.
Синтез органических
препаратов /сборник 1/. 1949. 66-67.
6.
Альберт А., Сержент Е. константы
ионизации кислот и оснований. М.-Л.: Химия. 1964, 179 с.
7.
Albert A., Serjeant E. The determination of Ionization Constants. 3 rd.
edn. – London and New York: Chapman and Hall. 1984.