Химия и химические технологии / 6. Органическая химия
К.х.н. А.В.Любяшкин, д.х.н. М.С.Товбис
Сибирский
государственный технологический университет, Россия
660049,
Красноярск, пр. Мира, 82; e-mail: tovbis@bk.ru
синтез нитрозонафтилпиразолов
Производные пиразолов нашли широкое применение в
качестве фармацевтических препаратов. Широко применяются в фармакологии
анальгин, амидопирин, антипирин и другие классические средства на основе
пиразолов.
В последнее время возрос интерес к новым
производным нитрозопиразола. Так, недавно были получены нафтилзамещенные
пиразолы конденсацией нафтилзамещенных β-дикетонов с гидразином [1].
Однако ввести в такие пиразолы нитрозогруппу не удается. Нитрозогруппу можно легко
восстановить до аминогруппы, что открывает путь синтеза новых аминопиразолов,
обладающих биологической активностью [2]. Поэтому мы решили ввести
нитрозогруппу в исходный β-дикетон
и получить новые нитрозозамещенные нафтилпиразолы.
Для
этого мы синтезировали нафтилзамещенные 1,3-дикетоны (I а-в) конденсацией ацетонафтонов с этилацетатом либо
этилпропионатом в абсолютном эфире. Так синтезировали 1-(1-нафтил)бутандион-1,3
и 1-(2-нафтил)бутандион-1,3, а также неизвестный ранее
1-(2-нафтил)пентандион-1,3 (Iв).
Соединения идентифицировали по ЯМР 1Н спектрам,
хроматомасс-спектрам, данным элементного анализа и ИК спектроскопии.
Полученные
дикетоны нитрозировали нитритом натрия, впервые получая изонитрозопроизводные
дикетонов с нафтильным заместителем (II а-в) [3]. На схеме 1 показан такой синтез на примере
2-нафтилзамещенных β-дикетонов.
Все
изонитрозодикетоны представляют собой белые кристаллические вещества с четкими
температурами плавления (таблица 1). Нитрозирование
1-фенил-3-(2-нафтил)пропандиона-1,3 (Iг на
схеме 1) осуществить не удалось.
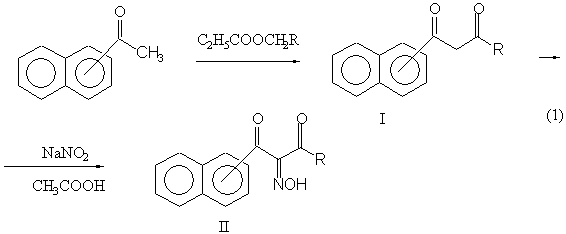
Iа – 1- нафтил, R – CH3 IIа – 1- нафтил, R – CH3
Iб – 2- нафтил, R – CH3 IIб – 2- нафтил, R – CH3
Iв – 2- нафтил, R – C2H5 Iв – 2- нафтил, R – C2H5
Iг – 2- нафтил, R – фенил
Таблица 1
Физико-химические
характеристики изонитрозо-β-дикетонов нафталинового ряда
|
Соединение |
Выход,% |
Т пл. 0С |
ЯМР 1Н, δ, м.д. |
ИК спектр, ν, см-1 |
Масс спектр |
|
IIa |
59 |
169-170 |
3.3с (СН3), 7.6-9.2 м (нафтил) |
1651(СН3С=О), 1689 (нафтилС=О), 3394 (OH), 988 (N-O) |
241(М+), 224, 198, 155, 139, 127. |
|
IIб |
57 |
173-174 |
2.54 с (СН3),7.6-8.4 м (нафтил) |
1645 (СН3С=О), 1679 (нафтилС=О), 3180 (OH), 998 (N-O) |
241 (М+),
224, 198, 181, 155, 127. |
|
IIв |
84 |
121-122 |
1.2 т (СН3), 3.1 к (СН2),
7.6-8.4 м (нафтил) |
1653 (СН3С=О), 1686 (нафтилС=О), 3210 (OH), 990 (N-O) |
181 (10), 155 (100), 127 (95). |
В дальнейшем мы проводили изучение реакции
циклизации новых изонитрозодикетонов (схема 2) с гидразином и алкилгидразинами
в различных условиях: с водными гидразинами в виде свободных оснований, с
сульфатами гидразинов в водно-содовом растворе, с гидразинами в ледяной
уксусной кислоте[4]. 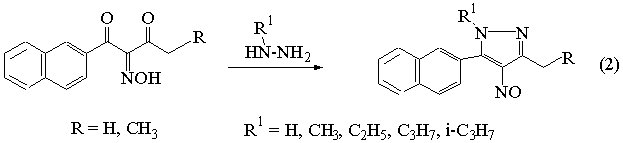
Таблица 2
Физико-химические
характеристики нафтилзамещенных нитрозопиразолов
|
№ |
R
|
R1 |
Т пл, оС |
Выход % |
λ max(нм), ε |
ЯМР 1Н |
|
IIIа |
H |
H |
170 |
81 |
710 (49.8) |
2.29 с (СН3),
7.5-8.8 м (С10Н7) |
|
IIIб |
H |
CH3 |
170 |
67 |
275 (15000), 315
(15000), 700 (69). |
3.9 с (СН3),
2.5 с (СН3), 7.55-8.20 м (С10Н7) |
|
IIIв |
H |
C2H5 |
86 |
63 |
275 (11160), 320
(9640), 700 (58) |
1.44т (СН3),
4.23к (СН2), 2.50 с (СН3), 7.5-8.7 м (С10Н7) |
|
IIIг |
H |
C3H7 |
92 |
49 |
275 (12300), 320
(10400), 710 (61.5) |
0.93 т (СН3),
1.88м (СН2), 4.15 т (СН2), 2.5 с (СН3), 7.96-8.2 м (С10Н7) |
|
IIIд |
H |
iС3H7 |
124-125 |
69 |
275 (13200), 320
(11600), 690 (61) |
1.5 с (СН3),
4.74 м (СН), 1.5 с (СН3), 2.5 (СН3), 7.96-8.18 м (С10Н7). |
|
IIIе |
СН3 |
H |
146 |
80 |
275 (13000), 700 (60) |
1.1 т (СН3),
3.0 к (СН2), 2.5 с (NH), 7.6-8.2 м
(С10Н7) |
|
IIIж |
СН3 |
C2H5 |
124 |
40.5 |
275(12800), 710 (61.5) |
0.7 т (СН3),
3.1 к (СН2), 0.7 т (N-СH2), 4.1
к (СН3), 7.4-8.7 м (С10Н7) |
Наилучшие результаты были получены в
водно-щелочной среде в качестве растворителя. Нитрозопиразолы выпадали из
водной реакционной массы либо высаживались из уксусной кислоты водой в виде
зеленого порошка. После перекристаллизации из водного этанола образовывались
ярко-зеленые кристаллы целевых продуктов. При этом получили ряд неизвестных
ранее 1,3-диалкил-5-нафтил-4-нитрозопиразолов (III а-з).
Работа выполнена при поддержке гранта КГАУ «Красноярского
краевого фонда поддержки научной и научно-технической деятельности»
индивидуальных проектов молодых ученых 2011 года.
Литература:
1.
Ahlrwalia V. K., Sharma H. R., Tyaqi R. Indian J. Chem. 1989, 23В, 195.
2.
Бартон Д. Общая
органическая химия. М.:Химия, 1982, 3, 58.
3.
Любяшкин А.В., Слащинин
Д.Г., Товбис М.С. Синтез изонитрозо-β- и α-нафтоилацетонов и
нитрозопиразолов на их основе: Статья в сб. трудов 3-го Международного форума
«Актуальные проблемы современной науки». Ч.8. Органическая химия. Самара, 2007.
С.33-35.
4.
Любяшкин А.В., Товбис
М.С. Синтез алкилзамещенных нитрозопиразолов с 2-нафтильным заместителем: Иваново, Изв. вузов. Химия и хим. технология. 2008.- Т.51.- Вып. 11.- С. 50-52.