Член-корр. НАН
Азербайджана, д.х.н., проф. Салахов М.С., док. фил., доцент Багманов Б.Т.,
м.н.с. Гречкина О.Т., диссертант Аббасов З.Т.
Институт
Полимерных материалов Национальной Академии Наук Азербайджана, Азербайджан
Перспективы расчетных методов в установлении пространственной структуры
в ряду норборнендикарбоновых кислот.
Ранее мы показали, что корреляционный
анализ зависимости топологи-ческих и квантовохимических данных и пространственного
строения N-арил-имидов норборнановых и
норборненовых систем может служить основой для прогнозирования тонких
структурных элементов еще не синтезированных веществ [1-3]. Была показана роль
электронных и стерических факторов, а так-же влияние заместителей в зависимости
от расположения в о-, м- и п- положе-нии в фенильном кольце в формировании
устойчивой конформационной структуры N-арилимидов норборнендикарбоновых кислот [4, 5].
Проведенные нами квантохимические расчеты [6],
спектральный анализ [7] и модельная визуализация структуры N - арилимидов
эндо- и экзо - бицикло /2.2.1/гепт-5-ен-2,3-дикарбоновых кислот (БГДК)
показали, что присутствие в о- положении ароматического кольца ОСН3-, Cl-, NO2- групп создает препят-ствие для свободного вращения фенильной
части молекулы в связи с большим объемом этих заместителей, что приводит к
образованию устойчивого конфор-мационного изомера, в котором фенильное кольцо
ориентировано перпенди-кулярно плоскости пятичленного имидного гетероцикла.
Такой факт позволяет использовать элементы пространственного строения при
проведении коре-ляционного анализа для структур подобного ряда.
С целью установления корреляционной
зависимости указанных конфигура-ционных и структурных особенностей с
результатами квантохимических и топологических расчетов нами проведен
сравнительный анализ эксперимен-тальных и расчетных данных для эндо- и экзо-,
эндоксо- БГДК, а также N-арил-имидов
эндо- и экзо- БГДК, содержащих в о-, м- и п- положении фенильного кольца
заместители различного электронного характера.
Результаты квантовохимических расчетов
эндо- (I), экзо-(II) и
эндоксо-(О)- ангидридов БГДК (рис.1), показывают, что для ангидрида эндо- (I) и экзо-(II) БГДК
полная энергия и энергия образования близки по значению, а электронная энергия
и теплота образования отличаются минимально.
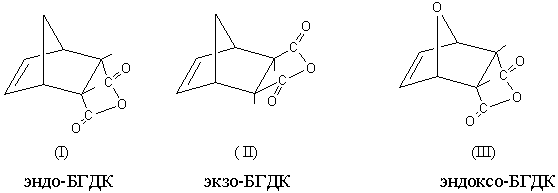
Рис.1 эндо- (I), экзо-(II) и
эндоксо-(О)- ангидриды БГДК
При сравнении квантовохимических данных ангидридов
БГДК (I, II) и
эндоксо-БГДК (О) разница становится существенной; полная энергия, электронная
энергия увеличиваются, а теплота и энергия образования уменьшаются.
На основе полученных
данных квантохимического расчета электронной плотности атомов и распределение
его в x, y, z направлениях для молекул эндо-, экзо- и
эндоксо-ангидридов БГДК построены молекулярные орбитали этих молекул
(дополнительные сведения об этом можно получить у авторов по e-mail: salahov_mustafa@mail.ru)
Распределение
электронной плотности в ангидридах норборнендикарбо-новых кислот и
отрицательный индуктивный эффект карбонильных групп при-водит к делокализации
электронной плотности у атомов С2, С3 (соответственно
0,60; 0,65). Видимо, образования неклассического карбкатиона и перегруппи-ровки Вагнера - Меервейна в ряду циклических дикарбоновых кислот и их
производных [8, 9] связаны именно с таким изменением электронной плотности
системы, по сравнении с направленным распределением электронной плотности у
самого норборнана.
Также известно, что атака
и присоединение к двойной связи норборненов осуществляется предпочтительно с
экзо-стороны [10, 11]. При этом равно-мерное распределение электронной
плотности в норборненах дает возможность подтверждать, что экзо - атака не
является следствием х, y, z направленности электронного заряда, а связана с
пространственным фактором – закрепленная ваннаобразная конформация
циклогексенового фрагмента в молекуле норбор-нена испытывает сильное
экранирующее влияние со стороны ангидридного кольца из-за уплощенности
шестичленного цикла, в результате чего обеспечивается экзо - присоединение [12,
13].
Результаты
квантовохимического расчета N - арилимидов эндо- и экзо - БГДК показывают, что значение расчетных данных для
этих соединений больше по сравнению с соответствующими данными для ангидридов.
Такое закономерное повышение энергетических характеристик является результатом
качественного и количественного осложнения структуры.
Схема 1
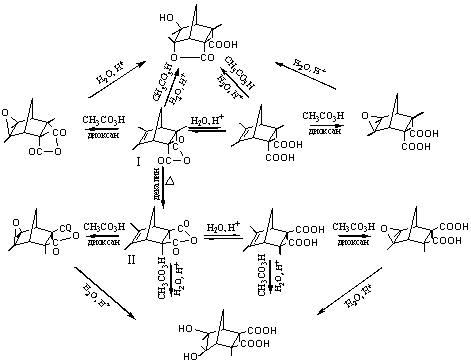
Схема 2
Рис.2 Схемы превращения норборненов
Изменение
энергетических характеристик наблюдается также при переходе от N-фенилимидов к N- (o-, м-, n- замещенным)
фенилимидам с различными заместителями электродонорного (СН3-, ОСН3-,
Сl-) и электроноакцепторного (NO2-, COOH-) характера. При переходе от N-фенилимидов к таковым с замес-тителями первого и
второго рода некоторые характеристики, например, полная, изолированная атомная
и электронная энергия, а также энергия и теплота обра-зования закономерно
повышаются. Это показывает, что в целом качественное осложнение молекулы
отражается в повышении энергии системы, где роль электронодонорных заместителей
количественно меньше, чем электроно-акцепторных. Следовательно, радикалы,
обогащающие электронную плотность бензольного кольца приводят к
термодинамически более устойчивой системе с низшей энергией, а электроно-
акцепторные заместители увеличивают напряжение и тем самым энергетические
характеристики молекулярных систем.
Исключение из этих
правил наблюдается в теплотах образования (Qобр). В N-фенилимидах БГДК Qобр выше,
чем таковые с электронодонорными замести-телями в мета- и пара-положениях
фенильного кольца. В о-замещенных N-арилимидах Qобр необычайно высоки, что объяснено нами как результат
атропо-изомерии [5]. Такой факт
подтвержден наличием двух неравноценных сигналов в ПМР спектрах для OCH3 группы
5,6-дигидрокси-N-арилимидов (VIIa, VIIб) в области
3,75 и 3,80 м.д., свидетельстующих о неравноценности положений присоединения
метоксильного фрагмента (рис.3).
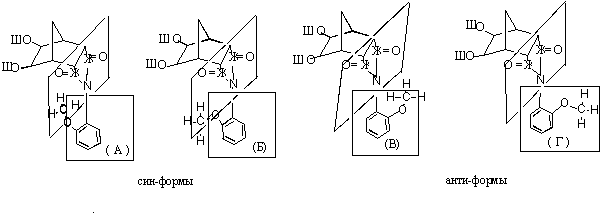
Рис.3
Изомерные формы орто- метоксифенилимидов эндо- норборнендикарбоновых кислот
Большой барьер вращения
вокруг N-С связи в о-изомерах N-замещенных арилимидов возникает из-за стерического
препятствия заместителей в фенильной части с карбонильными группами имидного
кольца. Это приводит к нарушению плоского строения N-арилимидного фрагмента – повороту бензоль-ного кольца
относительно плоскости пятичленного гетероцикла, где выгодна реализация лишь
анти-изомеров (В и Г) и удлинению связи N-С по сравнению со средним значением. В результате
увеличивается внутримолекулярное взаи-модействие, приводящее к более
напряженной системе и большому Qобр для
этих молекул.
Для нахождения зависимости «структура-свойство» в ряду норборненов нами
использован также топологический подход, основанный на применении
топологических индексов для количественной характеристики молекулярного графа,
так как этот метод позволяет описывать структуру молекулы в числен-ном виде и
устанавливать зависимость между свойствами соединений и их структурой.
Проводимые нами исследования с целью
применения различных тополо-гических индексов [14, 15] показывают, что
теоретико-информационные индек-сы, основанные на использовании универсальной
формулы Шеннона для оценки неоднородности системы, являются наиболее
подходящими в этом плане, так как понятие окрестность включает в себя
направленность и взаимо-действие соседствующих групп [16, 17].
![]()
![]() (1)
(1)
где ni - количество
элементов в подмножестве; i, n –
суммарное количество всех элементов системы, равное ![]() .
.
Топологические индексы информационного
содержания графа относи-тельно окрестности к-го
порядка (ICk), полного
информационного содержания (TICk),
структурного информационного содержания (SICk) и комплементарного информационного содержания (CICk) выведены на основе формулы Шеннона и вычисляются по
формулам (2) – (6).
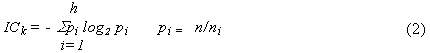
TICk
= n× ICk (3)
SICk
= ICk / log2n (4)
CICk=
log2n - ICk (5)
ВICk= ICk /log2N (6)
где n
–число вершин графа в i-ном классе
эквивалентности, N-число связей в молекуле.
Информационное содержание графа можно
рассматривать как количествен-ную меру их относительной сложности. Например,
для окрестности данного порядка ICk максимально,
тогда как все вершины различны, а для наиболее симметричного графа ICk равно нулю.
Используя формулы (1-6) мы рассчитали
индексы ICk, TICk, SICk, BICk
и CICk для ангидридов эндо-,
экзо- и эндоксо-БГДК. Из результатов расчета видно, что по мере увеличения
порядка окрестности разбиение возрастает. Так, например, разбиение на
окрестности первого порядка сохраняет эквивалент-ность Н1, Н2,
Н3, Н4, Н5, Н6, Н7, Н7¢, но приводит к отнесению С5, С6,
С7, С8, С9 в иные классы эквивалентности.
Рассчитанные индексы для ангидридов БГДК
одинаковые и не различают эндо- экзо - конфигурацию соединений. В молекуле ангидрида
эндоксо - БГДК замена метиленовой группы атомов кислорода приводит к
качественному и количественному изменению состава молекулы и содержания графа:
меняется кратность ребер и соседи первого порядка, что в дальнейшем
используется для расчетов информационного содержания. Это приводит к увеличению
ICk, SICk, BICk
и уменьшению TICk, CICk
при переходе от ангидрида БГДК к эндоксо-БГДК.
Теоретико-информационные индексы ICk, TICk, SICk, CICk служат коли-чественной мерой относительной сложности
графа [18]. Графы молекул N-арилимидов
БГДК с заместителями электродонорного и электроакцепторного характера в o-, м-, n-положениях фенильного кольца, по сложности и симмет-рии
отличаются от графических изображений соответствующих ангидридов. Анализ данных
топологических индексов симметрии окрестности для N-арил-имидов эндо- и экзо-БГДК показывает, что эндо-
или экзо - конфигурация имидного кольца и нахождение разных по составу и
строению заместителей в o-, м-, n-положениях
фенильного радикала не приводит к существенным изменениям в результатах
расчета. Значения ICk, TICk, SICk, BICk
и CICk (к=0-2) для этих соединений изменяются закономерно; в
N-фенилимидах IC0, IC1, SIC0, SIC1, SIC2, BIC0, BIC1, BIC2 ниже, чем соответсвующие данные для ангидридов, а IC2
выше. TICk, CICk во всех N-арилимидах
независимо от характера заместителя для всех индексов имеет большое значение.
При этом, как правило, данные для соединения с заместителем СООН и NO2
(электроноакцепторные группы) выше, чем для соответствующего соединения с заместителем
ОСН3, Cl (электронодонорного характера)
за исключением CIC1 и CIC2.
Такая законно-мерность наблюдается также при использовании других заместителей
соответсвующего электронного характера. На основе данных топологических
индексов симметрии окрестности N-арилимидов
эндо- и экзо-БГДК можно делать вывод о том, что эти расчетные параметры можно
использовать как показатель степени осложнения молекулы в качественном и
количественном отношении и характера заместителей в фенильной части для данной
серии соединений.
Сопоставляя данные топологических индексов
и квановохимических расчетов для эндо-,
экзо- и эндоксо-ангидридов можно обнаружить, что при переходе от нулевого
порядка к первому и второму ICk, TICk, SICk, BICk
законо-мерно увеличиваются, что коррелируются с данными полной, изолированной
атомной и электронной энергией, а CICk, как и теплота и энергия образования – уменьшается.
Индексы информационного содержания графа относительно окрестности k-го порядка
(ICk), полного информационного содержания (TICk), структурного информационного содержания (SICk) и информационного содер-жания связывания (BICk) коррелируется с полной, изолированной атомной и
электронной энергии, а индексы коплементарного информационного содер-жания (CICk) хорошо коррелируется с теплотой и энергией
образования.
Проведенный корреляционный анализ между
физическими данными, квантовохимическими расчетами и топологическими
индексами N-арилимидов эндо- и экзо-БГДК показывает, что
некоторые параметры имеют точную, а другие слабую корреляцию. В графиках (рис.4-7)
представлены примеры только части
корреляционных зависимостей, дающих строгую корреляцию топологических
индексов симметрии окрестности с теплотой образования, полной энергией и
температурой плавления.
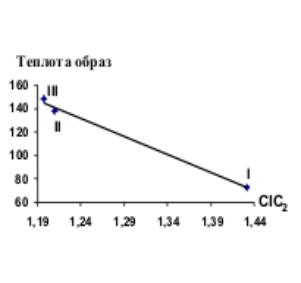
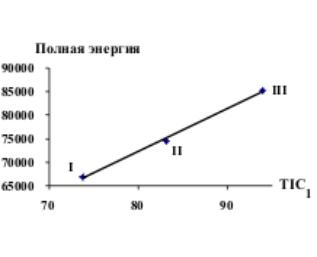
Рис.4 Зависимость
CIC2 от Qобр Рис.5 Зависимость TIC1 от Еполн
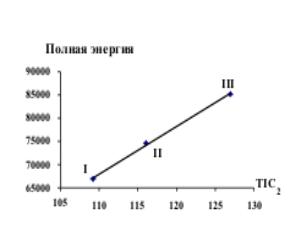
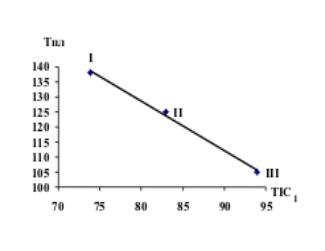
Рис.6 Зависимость TIC2 от Еполн Рис.7 Зависимость TIC1 от Тпл
Топологические индексы симметрии
окрестности по многим параметрам дают точную корреляцию с теплотой образования
(Qобр.). IC0, SIC0, BIC0, CIC1, SIC1, CIC2, SIC2, BIC2 идеально коррелируют
с Qобр, слабую корреляцию дают TIC0, IC1, BIC1, IC2, TIC1, TIC2.
Полная
энергия дает точную корреляцию с TIC0, TIC1, TIC2, слабая корреляция получается с IC1, CIC1, SIC1, BIC1, IC2, IC0, CIC2, BIC0, BIC2.
Все имиды циклических дикарбоновых кислот
являются твердыми веществами, и температура плавления этих веществ дает точную
корреляцию с TIC1 и TIC2. Более слабая корреляция наблюдается с IC0, SIC0, BIC0, CIC2, SIC2, BIC2.
По результатам корреляционной зависимости
топологических индексов с квантовохимическими расчетами и температурой
плавления можно сделать вывод о том, что теоретико-информационный индекс
полного информацион-ного содержания (TICk) дает строгую корреляцию с Епол. и Тпл.
и слабо коррели-руется с Qобр. Наоборот, Qобр. дает строгую корреляцию с индексами структур-ного
информационного содержания (SICk)
и комплементарного информацион-ного содержания (CICk).
Точная корреляционная зависимость между
полной энергией и темпера-турой плавления с индексами полного информационного
содержания является результатом суммарного значения этих параметров, которые
содержат в себе все параметры качественного, количественного и структурного
значения. Высокая корреляция Qобр. с индексом структурного информационного содержа-ния
доказывает, что существует органическая взаимосвязь между этими параметрами.
Детальное обсуждение данных результатов
будет предметом наших дальнейших исследований в этой области.
Литература
1.
Салахов М.С., Багманов
Б.Т., Гречкина О.Т. // Журнал структурной химии –2010. –51,
№1. –С. 22-25.
2.
Салахов М.С., Гречкина
О.Т., Багманов Б.Т. // Материалы VII Междуна-родная научно-практическая конференция «Новейшие достижения европейской науки -2011», 2011, София, т.35,С.78-79.
3.
Салахов М.С., Гречкина О.Т.,
Багманов Б.Т., Умаева В.С.// Журнал Доклады АН Азербайджана, Баку, 2011, №2,с.74-81
4.
Салахов М.С., Багманов
Б.Т., Умаева В.С., Багманова М.И. // ЖОрХ., 2007, 43, №5, С.684-689.
5.
Салахов М.С., Багманов
Б.Т., Набиев Н.С. // ЖОрХ. – 2010. – 46,
№11. – С.1622-1627.
6.
Багманов Б.Т. // Журнал Химические проблемы,
Баку, 2010, №2, С. 163-174.
7.
Багманов Б.Т. // ЖОрХ, 2007, вып.43, №11,
С.1640.
8.
Салахов М.С., Багманова М.И. // ЖОрХ, 2002,
вып.38, №2, С.265.
9. Bakhash v // Nonclassical carbocations. Top.
Cur. Chem., 1984, v.116/117, P.1-265.
10.
Can Н., Zahn D., Balçы М., ет
алл. Еур.//
Ъ. Орэ. Жщем., 2003, №6, П.1111- 1117.
11. Horf H. Classic in Hydrocarbons Chemistry,
Weinhelm; Wiley-VCH, 2000, 320p.
12. Багманов Б.Т., Салахов М.С., Багманова М.И., Мустафаев
М.М. // Материа-лы конф., посвященной 90-летию акад. Б.Зейналова, Баку, 2007,
С.30.
13. Багманов Б.Т.
// Азерб. Хим. ж., 2010, №1, С.62.
14.
Salakhov M.S., Bagmanov
B.T., Qrechkina O.T. // International Academy of Science., Insbruck–Baku.,
2009. №3., Р.504.
15. Салахов М.С., Багманов
Б.Т., Гречкина О.Т. // Журнал Структурной Химии, 2010, т. 51, №1, С. 22.
16. Салахов М.С., Гречкина О.Т., Багманов Б.Т. //
Журнал Доклады АН Азербайджана, Баку, 2010, №1, С. 55-59.
17. Салахов М.С.,
Гречкина О.Т., Багманов Б.Т. // Журнал Структурной Химии, 2010, т. 51, №5, С. 833-888.
18. Скворцова
М.И., Федяев К.С., Палюлин В.А., Зефиров Н.С. // Изв. РАН, Сер. хим., 2004, №8,
С. 1527-1532.