Химия и химические технологии/6. Органическая
химия
Д.х.н. Геворкян А. А., д.х.н.
Аракелян А.С.
Свойства атомов и молекул в единицах заряда
Центр органической
и фармхимии НАН Армении, Армения.
Современная теория химии, как
правило, дезориентирует, чем служит путеводителем для решения проблем теории и
синтеза. Причина – одна и неоспорима: хотя химия наука о взаимодействии противоположно заряженных частиц, но
сродства атомов и молекул оцениваются не в единицах заряда, а энергии и
скорости. Сомнение об этих мерах оценок сродства усилилось после того, как мы
смогли доказать, что экспериментального обоснования не имеют ни
"термодинамический, ни кинетический контроли" поведения молекул.
Более того, та же теория атомам приписывает два типа нейтральности: одна для
шести инертных газов, другая – для всех остальных. И это притом, что такие «нейтральные» частицы вступают в
химические реакции, обнаруживая свойства заряженных частиц. Даже после 1954 г.,
когда Л. Полинг за открытие электроотрицательности (ЭО), согласно которому все
атомы (кроме инертных газов), носят положительные заряды, удостоился
Нобелевской премии, химики продолжали приписывать положительно заряженным
частицам отрицательные свойства, а отрицательным – положительные (особенно в
химии фосфора).
Вопреки подозрению и
вседозволенности большинства химиков, мы доказательствам Полинга поверили, и
нашли более наглядное доказательство его идеи. Суть находки в том, что смогли
(впервые в истории химии) количественно оценить сродства атомов молекул в единицах
заряда, построенных на основе ЭО Полинга, тем самым доказав, что эта концепция
альтернативы не имеет. Конечно, после обнаружения факта, согласно которому с
потерей ЭО, атом теряет также свою реакционную способность. Фактически мы
доказали, что в химии взаимодействия инициируются лишь положительно заряженными
частицами (электрофилами). Это обнаруживается приданием ионному характеру химической связи признака
тензора с двумя значениями заряда (схема 1).
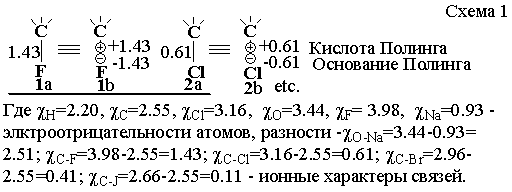
Неоспоримо также то, что это
соответствие между зарядами теории и
эксперимента, обусловлено именно природным происхождением меры оценки сродства
атомов нашей (и Полинга) находки (Рис. 1). 
Благодаря этому доказательству, мы обнаружили и решили такие
проблемы теории и синтеза, о существовании которых на базе известных воззрений
невозможно даже догадаться. Среди них: неоспоримое доказательство того, что все
химические реакции – только электрофильные, т.е. в природе нуклеофильных реакций
нет, а электроны инициировать химические реакции не в состоянии; сверхдальний
индукционный эффект алкильных групп; выявление неточности (на самом деле –
грубой ошибки) в реакционной способности галогеналканов RX согласно 1о<2о<3о,
а не наоборот; количественная характеристика ЖМКО, a- и скрытого a-эффектов, любых кислот и
оснований, в том числе сверх кислот и сверх оснований Ола и Полинга, физических
и биологических свойств; проблема региохимии конкурентных реакций
(доказательство и обоснование невозможности существования не конкурентных
реакций); зарядный контроль отщепления по правилам Зайцева и Гофмана; зарядная
характеристика уникальной роли водорода как кислоты Полинга; разгадка причины уникальности углерода связи
С-аммонио; обнаружение явления порога заряда для любой химической реакции;
возможность получения ответа даже на вопрос, какой из фактов эксперимента
достоверен, сомнителен или ошибочен; почему свойства атомов азота и
фосфора являются не аналогами, а антиподами; выявление ошибки в оценке полярности и в предсказании региохимии
присоединения электрофилов по двойной связи С=С; уточнение строения
3(5)-метилпиразола и обнаружение серии реагентов, которые с этой молекулой дают
не смесь, а только одно соединение; переаминирование аммониевых солей вторичными
аминами; предложение алгоритма для оценки зарядных сил атомов молекул и многое
другое.
Совокупность этих данных привел нас к выводу о том, что страны,
первыми осознавшие предстоящий переворот в решениях проблем химии и смежных
областей (в материаловедении, биологии,
нанотехнологии, окружающей среды, в поиске катализаторов и количественной
характеристике их свойств и т.д.), станут первопроходцами приложения этих
знаний и получателями сверхприбылей от них!
Поэтому, для иллюстрации
практической значимости находки, ниже приводим некоторую информацию
также об этом.
Например, мы смогли предложить экологически безупречный метод
синтеза безводных ди- и триметиламинов с выходами и чистотой более 95 %,
пригодного для применения, как для лабораторных, так и промышленных синтезов. Аналогично, 3(5)-метилпиразол, промышленно
доступный отход производства, при алкилировании всегда образует смесь изомерных
алкилатов 3(5)-метил пиразолов. Но с использованием принципов нашей находки,
нам удалось выявить (путем расчета величин зарядов атомов) множество молекул, с которыми удается
получить индивидуальные молекулы, содержащие фрагменты этого гетероцикла.
После обнаружения этих пороков, очевидно, независимо от чьей-либо воли, придется отказаться от указанных выше, хотя и
общепринятых, но умозрительных положений и символик. Тем более что для
понимания основ подхода и их приложения для решения проблем теории и синтеза,
не требуется какой-либо специальной подготовки, помимо обычного вузовского
курса по общей и органической химии и математики – на уровне знаний средней
школы. В отличие от всех известных воззрений современной теории, это обобщение
исключений не имеет и не признает.
Литература
1.
Геворкян
А. А. "Обобщенная теория кислот и
оснований. Новое воззрение на реакционную способность атомов и молекул".
Изд. Наука, Ереван, 2006 г. 158 с.
2.
Геворкян А.
А. Кислоты и основания Полинга. Хим. ж. Армении, 2007, 50, No 4,
713-730.
3.
Геворкян А.А. Вестник Академии
медико-технических наук РФ. 2009 No 1(2), 71-75.
4.
Геворкян А.А., Аракелян А.С., Джанджулян Ж.
Л., Микаелян А. Р., Петросян К. А., Паносян Г. А. ЖОрХ, 2005, 41, No 1, 134-140.
5.
Геворкян А. А.,
Аракелян А. С., Гапоян А. Т.,
Петросян К. А. и
Мовсисян А. А. Хим. ж. Армении. 2006, 59, No 4, 86-95.