Химия и
химические технологии/6. Органическая химия
Аспирант Гордеева И.В., д.х.н., профессор
Митрасов Ю.Н., доцент к.х.н. Кондратьева О.В., аспирант Лукичева Н.А.
ФГБОУ ВПО «Чувашский государственный
педагогический университет им. И.Я. Яковлева», Россия, г. Чебоксары
аминокислоты и дитиокарбаматы – Новые
трансформеры аддуктов пентахлорида фосфора и нуклеофилов
Известно, что реакции пентахлорида фосфора с
различными С-, N-, О- и S-нуклеофилами составляют
основу одного из методов синтеза фосфорилированных алкенов, которые
представляют повышенный интерес в качестве ценных полупродуктов
фосфорорганического синтеза [1, 2]. Особенностью метода является его
двустадийность: на первой стадии синтезируют аддукты пятихлористого фосфора и
нуклеофила; на второй – обрабатывают эти аддукты различными реагентами для
получения стабильных хлоридов фосфора (III, IV).
Несмотря на большой ассортимент, используемые агенты не вполне отвечают требованиям
современного производства вследствие различных причин: малой доступности, высокой
токсичности, горючести, многостадийности технологического процесса, большого
количества неиспользуемых отходов, низкой скорости процесса и в ряде случаев
из-за низких выходов.
В связи с этим целью проекта явилась разработка
новых, более эффективных и технологичных трансформеров органилтрихлорфосфоний-
гексахлорфосфатов до органилдихлорфосфонатов ( или -тиофосфонатов).
Нами было найдено, что для этих целей
перспективно использование
легкодоступных и безопасных в обращении аминокислот и N,N-диэтиламидо-дитиокарбамата
натрия. Взаимодействие органилтрихлорфосфоний гексахлорфосфатов (1а-е) с аминокислотами осуществляли при
эквимольном соотношении реагентов. В качестве C- и O-нуклеофилов
для синтеза соединений хлорфосфония были использованы выпускаемые отечественной
промышленностью стирол, α-метилстирол, 1-гексен, 1-гептен, диэтилацеталь
уксусного альдегида и тетрагидрофуран; аминокислот – глицин, лизин,
α-аминокапроновая и сульфаниловая кислоты. Оказалось, что сульфаниловая
кислота при комнатной температуре не реагирует с соединениями (1а-е). В случае аминокарбоновых кислот
реакции протекали с достаточно высокой скоростью при 20–25оС и в среднем
завершались через 0,1–0,2 ч после смешения реагентов. В ходе процесса трансформации
аддуктов (1а-е) при необходимости
применяли охлаждение, так как смешение компонентов сопровождается
незначительным разогреванием реакционной смеси. При этом образовывались
растворы желто-оранжевого цвета и выпадали осадки, которые являются
гидрохлоридами хлорангидридов аминокислот, что было подтверждено качественной
реакцией с нитратом серебра, данными количественного анализа и ИК-спектров.
После отделения осадка перегонкой фильтрата были получены органилдихлорфосфонаты
(2а-е) (табл. 1).
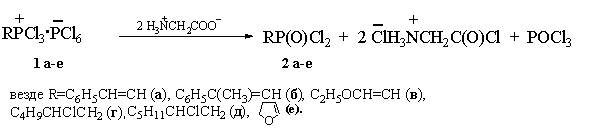
В качестве побочных продуктов образуются гидрохлориды
хлорангидридов соответствующих аминокислот. На это указывают данные элементного
анализа и ИК-спектров, в которых содержатся полосы поглощения N–H
(3150-3305, 1610-1658 см-1) и C=O
(1716-1736 см-1) связей.
При обработке разбавленным раствором гидроксида натрия
гидрохлориды хлорангидридов аминокислот могут быть превращены в аминокарбоновые
кислоты, которые можно использовать повторно, что повышает экономичность
процесса.
Реакции органилтрихлорфосфонийгексахлорфосфатов
(1а-д) с N,N-диэтиламидодитиокарбаматом
натрия легко протекают в мягких условиях. При этом наблюдалось постепенное
растворение кристаллических аддуктов и после окончания реакций образовывались
растворы желто-оранжевого цвета. Одновременно с гомогенизацией выпадал осадок
хлорида натрия, который был идентифицирован качественной реакцией с нитратом
серебра и дигидроантимонатом калия на наличие ионов хлора и натрия
соответственно. После отделения осадка и перегонки фильтрата были получены
органилдихлортиофосфонаты (3а-д)
(табл. 2).
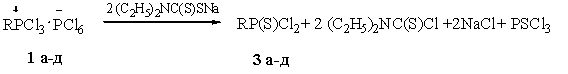
Строение соединений (2а-е, 3а-д) было
подтверждено методами ИК- и ЯМР 31Р-спектроскопии
К достоинствам
предлагаемых трансформеров относится также и то, что при использовании
аминокислот и N,N-диэтиламидодитиокарбамата натрия происходит
связывание хлористого водорода, что исключает возможность протекания побочных
реакций гидрохлорирования и повышает чистоту алкенилдихлорфосфонатов, выхода
которых выше или не уступают известным в литературе.
Таким образом,
установлено, что реакции аминокислот и N,N-диэтилами-додитиокарбамата
натрия с органилтрихлорфосфонийгексахлорфосфатами протекают с высокой скоростью
в среде бензола. Для их проведения не требуется сложного аппаратурного
оформления, а внедрение метода приводит к существенному повышению чистоты
продукции, увеличению производительности труда и улучшению
санитарно-гигиенических условий труда.
Таблица 1
Выходы,
константыа и данные элементного анализа дихлорангидридов
органилфосфоновых
кислот (2а-е)
|
№ соед. |
Выход,
%
|
Т. кип., оС, (р, мм рт. ст.) |
d420 |
nD20 |
Найдено, % |
Формула
|
Вычислено, % |
||
|
Cl |
P |
Cl |
P |
||||||
|
2аб, в |
95 |
175-7 (15) |
– |
– |
32.23 |
14.11 |
С8Н7Cl2OP |
32.08 |
14.01 |
|
2б |
81 |
168-9 (10) |
1.3209 |
1.5916 |
30.17 |
13.12 |
C9H9Cl2OP |
30.21 |
13.19 |
|
2в |
85 |
100-1
(5) |
1.3265 |
1.4952 |
37.68 |
16.45 |
С4Н7Cl2O2P |
37.52 |
16.39 |
|
2гв |
70 |
138-9 (15) |
1.2734 |
1.4863 |
44.90 |
13.11 |
С6Н11Cl3OP |
44.87 |
13.07 |
|
2д |
72 |
137-9 (10) |
1.2418 |
1.4856 |
42.48 |
12.40 |
С7Н13Cl3OP |
42.45 |
12.36 |
|
2еб |
71 |
113-5 (6) |
– |
– |
37.95 |
16.59 |
С4Н5Cl2O2P |
37.92 |
16.57 |
Примечание: а) литературные данные [1-3]; б) т.
пл.оС: 70–71 (2а), 51–52
(2е);
в)
спектр ЯМР 31Р (δ, м.д.): 32 (2а), 42 (2г).
Таблица 2
Выходы, константыа
и данные элементного анализа дихлорангидридов
органилтиофосфоновых
кислот (3а-д)
|
№ со-ед. |
Выход,
%
|
Т. кип. оС, (р, мм рт. ст.) |
d420 |
nD20 |
Найдено,
%
|
Формула
|
Вычислено, % |
||||
|
Cl |
P |
S |
Cl |
P |
S |
||||||
|
3аб |
94 |
170-2 (10) |
1.3519 |
1.6437 |
29.86 |
12.90 |
13.41 |
С8Н7Cl2PS |
29.77 |
13.06 |
13.52 |
|
3б |
72 |
185-7 (10) |
1.3307 |
1.6432 |
26.56 |
11.63 |
12.05 |
C9H9Cl2OPS |
26.54 |
11.59 |
12.00 |
|
3в |
75 |
100-1 (4) |
1.3329 |
1.5417 |
32.17 |
14.05 |
14.56 |
С4Н7Cl2O2PS |
32.08 |
14.01 |
14.50 |
|
3гб |
61 |
128-9 (11) |
1.2938 |
1.5261 |
39.67 |
11.58 |
11.99 |
С6Н11Cl3OPS |
39.62 |
11.54 |
11.94 |
|
3д |
60 |
127-9 (6) |
1.2585 |
1.5218 |
37.69 |
10.98 |
11.41 |
С7Н13Cl3OPS |
37.64 |
10.96 |
11.35 |
Примечание:
а) литературные данные [1-3]; б) спектр ЯМР 31Р (δ, м.д.): 66 (3а), 82 (3г).
Литература:
1. Кормачев, В. В.
Реакции пятихлористого фосфора с органическими соединениями / В. В. Кормачев,
Ю. Н. Митрасов, В. А. Кухтин. – Чебоксары, 1978. – 172 c. – Деп. ОНИИТЭХим,
Черкассы, № 2576/79.
2. Кормачев, В. В. Реакции пятихлористого
фосфора с органическими соединениями. Сообщение II / В. В. Кормачев, Ю. Н.
Митрасов. – Чебоксары, 1983. – 82 с. – Деп. ОНИИТЭХим,
г. Черкассы, №1011хп – Д 83.
3. Kosolapoff, G.
M. Organic phosphorus compounds / G.
M. Kosolapoff and L. Maier – N. I. :
Wiley, 1972.– Vol. 4. – 531 p.