Биология
К. с.-х. н. Седых Т.А., д.б.н. Долматова
И.Ю.
Башкирский государственный аграрный
университет, Россия
Оценка аллелофонда
крупного рогатого скота
герефордской породы,
разводимого в Предуральской
степной зоне
Башкортостана
Одной важнейших
задач отрасли животноводства является совершенствование количественных и
качественных параметров сельскохозяйственных животных и для этого в настоящее
время накоплен большой объем ценнейшей научной информации, позволяющий повышать
генетический потенциал продуктивности животных и улучшать качество продуктов,
потребляемых населением [4,8,9].
Существенным резервом в
обеспечении населения страны конкурентоспособным сырьем является мясное
скотоводство. В целях реализации программы развития мясного скотоводства в Республику
Башкортостан в 2009 г. был завезен из Австралии крупный рогаты скот
герефордской породы, представленный популяциями, разводимыми в штатах Южная
Австралия, Виктория, Новый южный Уэльс и на о. Тасмания [2,3]. Изучение генетического
потенциала и оценка аллелофонда животных австралийской генерации и потомков первого
и второго поколения российской генерации представляет значительный интерес для
осуществления селекционно-племенной работы.
В настоящее время отмечается дефицит информации по изучению аллелофонда
мясного скота, завезенного из других стран и адаптированного к местным условиям.
Как отмечается в проведенных ранее исследованиях по изучению популяций крупного
рогатого молочного направления продуктивности оценка всего спектра
разнообразия, создание генетических паспортов пород требует изучения как можно
большего числа географически удаленных популяций. Существенный вклад в
характеристику аллельного разнообразия пород вносят региональные популяции,
формирование аллелофонда которых в большинстве случаев происходило в условиях
относительной географической изоляции [4,7,8]. В качестве инструмента для
изучения вопросов популяционной и эволюционной генетики находят применение молекулярно-генетические маркеры и одним из
высокоинформативных типов ДНК-маркеров, характеризующих генофонд, являются
микросателиты [5,9].
Целью работы
стало исследование с использованием микросателитов аллелофонда крупного
рогатого скота герефордской породы, разводимого в условиях Предуральской
степной зоны Башкортостана.
Материалы
и методы исследований. Исследования
проводились на базе ЦКП «Биоресурсы и биоинженерия сельскохозяйственных
животных» ГНУ ВИЖ Россельхозакадемии.
Материалом для исследований служили пробы
ткани (ушной выщип) крупного рогатого скота герефордской породы трёх
генетико-экологических генераций в количестве 66 голов, разводимых в МТС «Центральная»
Республики Башкортостан, в т.ч. завезённые из Австралии, (ГРФ_АВСТР, n=30), первой
российской генерации, (ГРФ_F1, n=26) и
второй российской генерации (ГРФ_F2, n=10). В
хозяйстве используется стойлово-пастбищная технология содержания мясного скота,
практикуются туровые отелы в зимне-стойловый период. Первые 6-8 дней
новорожденных телят содержат в индивидуальных боксах совместно с матерями,
затем коров переводят на выгульные площадки и используют режимный подсос.
Раздельное содержание коров и молодняка обеспечивает лучшие зоогигиенические
условия для телят и сокращает затраты. В летний период коровы и телята
содержатся на естественных пастбищах, осенью в конце пастбищного периода
молодняк переводится на доращивание и на откормочные площадки, где находятся,
как правило, до 18-20-месячного возраста. Коровы и быки содержатся зимой на кардах.
Выделение ДНК проводили с помощью набора
реагентов для выделения ДНК DIAtomTM DNA Prep100 (ООО «Лаборатория Изоген»,
Россия). Анализ ДНК и постановку ПЦР проводили по методикам, разработанным
ранее [5]. Набор маркеров для анализа включал 9 микросателлитных локусов -
TGLA126, TGLA122, TGLA227, ILST005, ETH185, ETH10, ETH225, BM1818 и BM2113.
Фрагменты амплификации идентифицировали на генетическом анализаторе ABI Prism
3130xl («Applied Biosystems», США). Статистическую обработку данных проводили
по стандартным методикам [1] с использованием программного обеспечения GenAlEx
v 6.4 [11] и PAST в соответствии с методическими подходами, разработанными в
ГНУ ВИЖ РАСХН [10].
Результаты собственных исследований. Микросателлиты
характеризуются высоким уровнем полиморфизма и стабильным аутосомным кододоминантным
наследованинм, вследствие чего являются удобными генетическими маркерами в
геноме сельскохозяйственных животных.
Аллельные частоты по микросателлитным
маркерам герефордского скота австралийской генерации приводятся на рисунке 1.
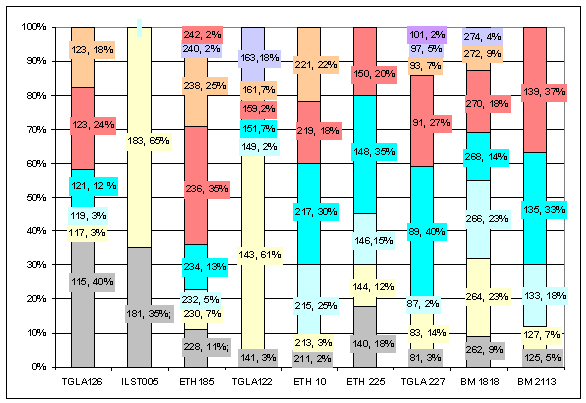
Рис. 1 Аллельные частоты по микросателлитным маркерам
герефордского скота австралийской
генерации
Анализируя полученные данные
можно утверждать, что у крупного рогатого скота австралийской генерации число
аллелей на локус микросателлитов варьировало в пределах от 2 до 8, при среднем
значении - 6,00±0,62.
Аллельные
частоты по микросателлитным маркерам первого поколения герефордского скота
русской генерации приводятся на рисунке 2.
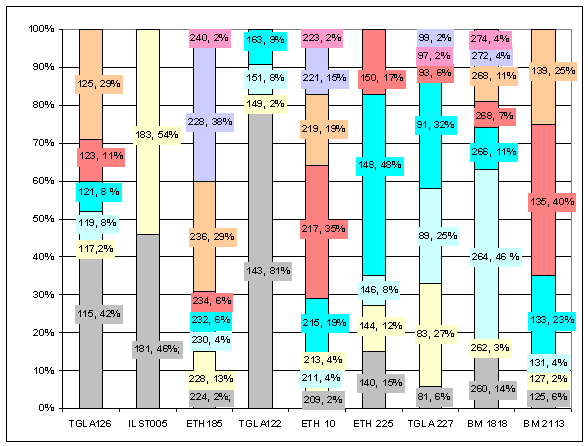
Рис. 2 Аллельные частоты по
микросателлитным маркерам
первого
поколения герефордского скота русской генерации
На рисунке 2
показано, что у первого поколения герефордов местной генерации число аллелей на локус микросателлитов варьировало в
пределах от 2 до 8, при среднем значении - 6,00±0,69.
Аллельные частоты
по микросателлитным маркерам второго поколения герефордского скота русской генерации
представлены на рисунке 3.
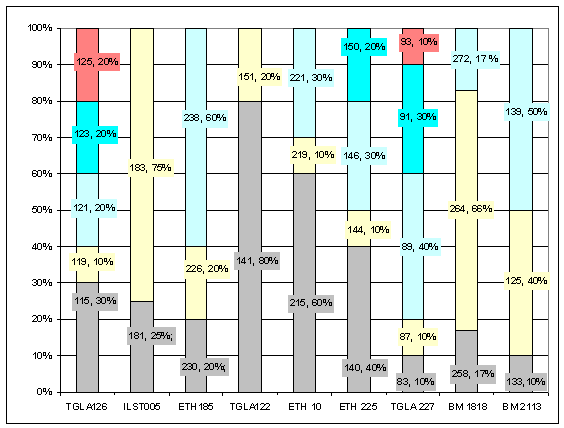
Рис. 3 Аллельные частоты по
микросателлитным маркерам второго поколения герефордского скота русской
генерации
Данные рисунка 3 свидетельствуют
о том, что у второго поколения герефордов местной генерации число аллелей на локус микросателлитов варьировало в
пределах от 2 до 5, при среднем значении - 3,33±0,37.
Таким образом, исследуемые
выборки крупного рогатого скота характеризуются невысоким уровнем генетического
разнообразия: среднее число аллелей на локус микросателлитов составило 6,00 в
генерациях ГРФ_АВСТР и ГРФ_РФ_F1
и снизилось до 3,33 аллеля в генерации ГРФ_РФ_F2.
В ходе исследований
так же установлено, что число эффективных аллелей в локусах TGLA126, TGLA122,
TGLA227, ILST005, ETH185, ETH10, ETH225, BM1818 и BM2113 составило в среднем в
генерации ГРФ_АВСТР 3,79±0,39, в генерации ГРФ_РФ_F1 - 3,32±0,32 и в генерации ГРФ_РФ_F2 - 2,59±0,34. Таким образом, у потомков показано снижение эффективных
аллелей с 3,79 до 2,59 аллеля в генерации.
Индекс Шеннона,
используется в экологических исследованиях для оценки генетического
разнообразия. В нашем случае для исследованных локусов в среднем он составил в
генерации ГРФ_АВСТР 1,44±0,12, в генерации ГРФ_РФ_F1 – 1,35±0,13 и в генерации ГРФ_РФ_F2 – 0,99±0,12. Таким образом, в местных генерациях наблюдается
снижение данного показателя.
В таблице 1
представлены сведения о наличии информативных и эффективных аллелей, а также
индекс Шеннона в целом по изученной популяции животных.
Таблица 1 Наличие
информативных и эффективных аллелей
|
Показатель |
Локус |
В среднем, M±m |
||||||||
|
TGLA126 |
ILST005 |
ETH185 |
TGLA122 |
ETH 10 |
ETH 225 |
TGLA 227 |
BM 1818 |
BM 2113 |
||
|
Na |
5,667±0,333 |
2,000±0,000 |
6,333±1,667 |
4,333±1,453 |
5,667±1,453 |
4,667±0,333 |
6,667±0,882 |
6,000±1,528 |
4,667±0,882 |
5,11±0,40 |
|
Ne |
3,937±0,318 |
1,808±0,113 |
3,538±0,655 |
1,775±0,291 |
3,654±0,744 |
3,643±0,332 |
3,802±0,128 |
3,832±1,087 |
3,132±0,376 |
3,24±0,22 |
|
I |
1,498±0,033 |
0,633±0,038 |
1,418±0,235 |
0,797±0,217 |
1,374±0,242 |
1,402±0,074 |
1,518±0,051 |
1,453±0,297 |
1,245±0,151 |
1,26± 0,08 |
Примечание: Na – информативные аллели; Ne – эффективные аллели, I – индекс Шеннона.
Анализируя полученные
данные в аспекте отдельных локусов, наименьшее генетическое разнообразие у
исследованных популяций установлено по локусу ILST005 – 2,0 аллеля во всех
генерациях. Наибольшее генетическое разнообразие выявлено в локусе TGLA227 – 6,7 аллеля, с диапазоном от 5 до 9 в
исходной, завезённой группе австралийской генерации.
Вывод. На основании
проведенных исследований полиморфизма 9 микросателитных локусов популяции
крупного рогатого скота герефордской породы австралийской генерации и их
потомков первого (F1) и
второго (F2) поколений показано,
что в трёх последовательных генерациях животных происходит снижение числа
аллелей во втором поколении.
В разрезе изученных генераций установлено в локусах TGLA126, TGLA122, TGLA227,
ILST005, ETH185, ETH10, ETH225, BM1818 и BM2113 у потомков первого (F1) и второго (F2), снижение числа эффективных аллелей с 3,79 (ГРФ_АВСТР) до 2,59 (ГРФ_РФ_F2) аллеля в генерации и
индекса Шеннона с 1,44±0,12 (ГРФ_АВСТР)
до 0,99±0,12 (ГРФ_РФ_F2).
Наименьшее
генетическое разнообразие у исследованных популяций установлено по локусу
ILST005 – 2,0 аллеля во всех генерациях. Наибольшее генетическое разнообразие
выявлено в локусе TGLA227
– 6,7 аллеля, с диапазоном от 5 до 9 в исходной, завезённой группе австралийской
генерации.
С чувством глубокой признательности благодарим
Гладырь Е.А., канд. биол. наук, заведующую лабораторией молекулярной генетики
животных и сотрудников ЦКП «Биоресурсы и биоинженерия сельскохозяйственных животных»
ГНУ ВНИИЖ Россельхозакадемии за помощь, оказанную в проведении исследований.
Литература:
1.
Вейр Б. Анализ
генетических данных // М.: Мир, 1995. 319 с.
2.
Гизатуллин
Р.С., Седых Т.А. Резервы увеличения производства говядины в Башкортостане // Вестник Башкирского государственного
аграрного университета.
2011. № 3.
С. 25-29.
3.
Гизатуллин
Р.С., Хазиахметов
Ф.С., Седых Т.А.,
Мударисов Р.М. Ресурсосберегающая технология разведения мясного скота и
производства говядины: рекомендации. – Уфа:
Издательство Башкирский ГАУ, 2013. – 64 с.
4. Долматова И.Ю. Зиновьева
Н.А., Горелов П.В., Ильясов А.Г., Гладырь Е.А., Траспов А.А., Сельцов В.И.
Особенности аллелофонда башкирской популяции симментальского скота по
микросателитам // Сельскохозяйственная биология. 2011. №6. С. 70-74.
5.
Зиновьева Н.А., Гладырь Е.А. Генетическая
экспертиза сельскохозяйственных животных: применение тест-систем на основе
микросателлитов // Достижения науки и техники АПК. 2011. № 9. С. 46-48.
6.
Зиновьева Н.А.,
Попов А.Н., Эрнст Л.К., Марзанов Н.С., Бочкарев В.В., Стрекозов Н.И., Брем Г.
Методические рекомендации по использованию метода полимеразной цепной реакции в
животноводстве // Дубровицы. ВИЖ, 1998. 47 с.
7.
Зиновьева Н.А., Стрекозов Н.И.,
Молофеева Л.А. Оценка роли
ДНК-микросателлитов в генетической характеристике популяции черно-пестрого
скота // Зоотехния. 2009. № 1. С.
2-4.
8. Траспов А.А., Зиновьева
Н.А., Долматова И.Ю., Гладырь Е.А. Аллелофонд башкирской популяции
черно-пестрого скота по микросателлитам в связи с показателями молочной
продуктивности коров // Проблемы биологии продуктивных животных. 2011. Т. 1. С.
65-68.
9. Эрнст Л.К., Зиновьева
Н.А. Биологические проблемы животноводства: монография. – М.:РАСХН, 2008. – 508
с.
10.
Nei, M. 1978. Estimation of
average heterozygosity and genetic distance from a small number of individuals.
Genetics 76: 379-390.
11.
Peakall, R., Smouse P.E. GENALEX
6: Genetic analysis in Excel. Population genetic software for teaching and
research. //. Molecular Ecology Notes, 2006, 6, 288-295. V. GENALEX 6.4 UTR: http://appliedpopulationgenetics2010.wikispaces.com/file/view/GENALEX6.4_documntation.pdf,
(дата
обращения
19.12.2010).