д.т.н., проф. Родионов И.В.
Саратовский государственный технический университет имени Гагарина
Ю.А., Россия
Получение
структурно-гетерогенных оксидных покрытий на медицинских металлических
имплантатах для травматологии и ортопедии
Статья подготовлена при
финансовой поддержке Минобрнауки РФ в рамках базовой части государственного
задания образовательным организациям высшего образования, подведомственным
Минобрнауки РФ (проект № 1189)
Введение
В ортопедической имплантологии особое место занимают биоактивные
керамические материалы, которые, как правило, в виде специальных функциональных
покрытий наносятся на компактные металлические основы изделий. Однако для
использования данных материалов в производстве медицинских имплантатов
чрескостного или внутрикостного назначения необходимо, чтобы керамические
покрытия обладали, кроме повышенной механической прочности и биокоррозионной
устойчивости, развитой морфологической структурой и высокой степенью
шероховатости поверхности, что достигается с помощью определенных технологических
методов нанесения покрытий.
В последнее время активно развиваются исследования по разработке и
внедрению биосовместимой металлооксидной керамики в производство имплантационных
конструкций, применяемых в лечении различных костных патологий
опорно-двигательного аппарата и челюстно-лицевого отдела [1-4]. При этом
получение указанной металлооксидной керамики в виде определенным образом
структурированных покрытий осуществляется относительно простыми, но
высокоэффективными способами термического оксидирования ортопедических и
стоматологических имплантатов, где в условиях их нагрева в той или иной
реакционной кислородосодержащей газовой среде на поверхности формируются слои
из металлооксидных соединений. Объемная и поверхностная структура этих слоев
определяется исходным состоянием поверхности имплантатов перед обработкой,
химическим и концентрационным составом выбранной реакционной окислительной
среды, режимами оксидирования. Для имплантатов, функционирующих в костной ткани
структура покрытий должна иметь развитую морфологию и высокую открытую
пористость, обеспечивающих интеграционное взаимодействие поверхности с
прилегающей костью, когда в условиях остеоинтеграции происходит прорастание
костных клеток в неровности покрытия и разрастание кости в структуре
поверхности имплантатов. Поэтому с целью получения оксидных покрытий с высокой
структурной неоднородностью и шероховатостью поверхность металлических
имплантатов необходимо предварительно обрабатывать, например, пескоструйной
обдувкой частицами корундового абразива, с созданием исходно выраженного микрорельефа.
Последующее оксидирование таких микрошероховатых поверхностей позволяет
сформированному покрытию приобретать высокоразвитый рельеф, являющийся
следствием воспроизведения оксидными слоями рельефа исходной микрошероховатой поверхности
металлической основы (рис. 1).

Рис. 1. Копирование
рельефа исходной микрошероховатой металлической поверхности имплантата оксидным
покрытием
Получаемые покрытия
с развитой морфологической структурой характеризуются повышенным уровнем
свободной энергии, высокой клеточной биоадгезивностью и коррозионной
устойчивостью, большой площадью удельной поверхности, что благоприятно влияет
на эффективность процесса сращения имплантатов с костной тканью и на прочность
их закрепления в тех или иных костных частях организма.
Методика
эксперимента
Были проведены
экспериментальные исследования по формированию оксидных покрытий на чрескостных
стержневых имплантатах, применяемых в травматологии и ортопедии при лечении
переломов различных костных сегментов. Опытные образцы в виде стандартных
резьбовых стержней для чрескостного остеосинтеза выполнялись из нержавеющей
хромоникелевой стали 12Х18Н9Т и титанового сплава ВТ6, широко используемых в
ортопедической имплантологии. Поверхность образцов предварительно
подготавливали с помощью пескоструйной обдувки мелкодисперсным (250-300 мкм)
корундовым порошком. Затем проводили ультразвуковую очистку и обезжиривание
поверхности в спиртовом моющем растворе.
Покрытия получали с
применением двух способов газотермического оксидирования: оксидирования в
атмосфере воздуха и в среде перегретого водяного пара. При этом образцы из
стали 12Х18Н9Т оксидировали на воздухе, а образцы из титанового сплава ВТ6 – в
атмосфере водяного пара. Режимы воздушно-термического оксидирования стальных образцов
предусматривали их нагрев в кварцевой печи электросопротивления при рабочих
температурах, составляющих 3000С и 3500С, с
продолжительностью обработки 1,0 ч и 1,5 ч. Режимы паротермического
оксидирования титановых стержней характеризовались значениями температуры 4000С,
5000С и продолжительностью процесса, равной 1,5 ч и 2 ч.
Полученные
результаты и их анализ
При исследовании
поверхностной структуры полученных оксидных покрытий методами оптической и
растровой электронной микроскопии было установлено, что термооксидированные
стальные (12Х18Н9Т) и титановые (ВТ6) поверхности характеризуются необходимой
для остеоинтеграции морфологической гетерогенностью с присутствием в структуре
покрытий металлооксидных частиц и открытых пор различного размера (табл. 1, 2).
Равномерность распределения этих структурных элементов морфологии изменяется в
зависимости от режимов и условий получения покрытий, что обусловлено термофизическими
особенностями окисления исходно микрошероховатых (поверхностно неоднородных)
металлических поверхностей.
С помощью растровой электронной микроскопии
установлено, что при взаимодействии атомов металла и кислорода на поверхности
стальных и титановых образцов формируются металлооксидные соединения микро- и
нанокристаллического строения с наличием большого количества пор и трещин для
прорастания костной ткани (рис. 2, 3). Такие поверхностно-пористые системы за
счет обеспечения высокой сорбционной активности способствуют интенсификации
фактора роста кости, т.е. остеостимуляции, вызывая ускорение процессов
костеобразования. Кроме того, при биофизикохимическом взаимодействии оксидного
покрытия с окружающей биосредой происходит образование и адгезия на поверхности
имплантатов белковых структур, их разрастание и проникновение в неровности, а
также в микро- и нанопоры покрытия. В результате такого взаимодействия
создается прочная биотехническая система «имплантат – окружающая костная ткань»
с высокой эффективностью функционирования.
Таким образом, за счет придания оксидным покрытиям гетерогенной микро- и
наноструктуры, а также высокой степени шероховатости и пористости достигаются
условия интеграции имплантатов с костной тканью, когда костные клетки прорастают
в имеющиеся открытые поры и неровности поверхности, создавая прочное
закрепление изделий в организме.
Таблица 1
Микроскопический анализ морфологии оксидных покрытий,
полученных на образцах из
нержавеющей стали 12Х18Н9Т при различных режимах воздушно-термического
оксидирования
|
t, °C |
τ, ч |
Полихроматическое микроизображение поверхности (х100) |
Монохроматическое микроизображение поверхности (х100) |
|
300 |
1,0 |
|
|
|
1,5 |
|
|
|
|
350 |
1,0 |
|
|
|
1,5 |
|
|
Таблица 2
Микроскопический анализ морфологии оксидных покрытий,
полученных на образцах из
титанового сплава ВТ6 при различных режимах паротермического оксидирования
|
t, °C |
τ, ч |
Полихроматическое микроизображение поверхности (х100) |
Монохроматическое микроизображение поверхности (х100) |
|
400 |
1,5 |
|
|
|
2,0 |
|
|
|
500 |
1,5 |
|
|
|
2,0 |
|
|

Путем проведения доклинических испытаний на лабораторных животных (кроликах) установлено, что стержневые титановые и стальные ортопедические имплантаты без термического оксидного покрытия (контрольная группа образцов) не проявили способность к интеграционному взаимодействию с костной тканью по истечении 50 суток испытания. На поверхности таких образцов отсутствовал костный регенерат, не происходило прочное соединение кости с имплантатами без микро- и нанокристаллического металлооксидного покрытия. Образцы имплантатов контрольной группы характеризовались низкой прочностью закрепления в костной ткани, с течением времени подвергались расшатыванию с проявлением воспаления окружающих тканей.
Термические оксидные покрытия с микро- и нанопористой структурой,
сформированные на титановых и стальных стержневых образцах, обеспечили
выраженную интеграцию поверхности с костью, о чем свидетельствует взаимосвязанная
с покрытием новообразованная костная ткань, выявленная на поверхности образцов
после их удаления из организма лабораторных животных (рис. 4, 5). Опытные
имплантаты с разработанными покрытиями проявили высокую биологическую совместимость, в результате которой на поверхности
образцов формировалось увеличенное количество молодой кости, прочно связанной с
покрытием. Это свидетельствует о протекании на такой термически модифицированной
поверхности интенсивного костеобразования и о способности применяемых оксидных
покрытий к ускоренному срастанию с костной тканью.
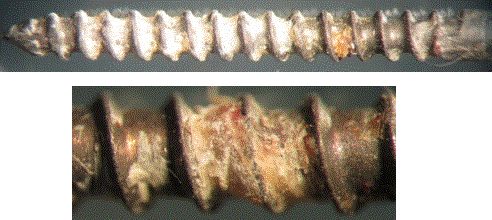
Рис. 4. Стержневой образец
из стали 12Х18Н9Т с воздушно-термическим оксидным покрытием,
остеоинтегрированным после испытания in vivo
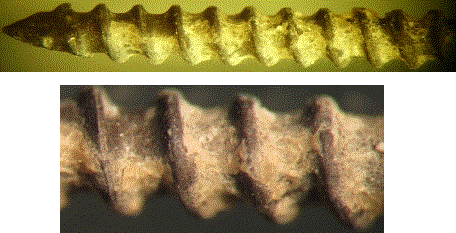
Рис. 5. Стержневой образец
из титанового сплава (ВТ6) с паротермическим оксидным покрытием,
остеоинтегрированным после испытания in vivo
Технологические и
методологические подходы получения оксидных биосовместимых покрытий легли в
основу создания новых методов медицинской физики и биоинженерии поверхности,
способствовали разработке уникальных инновационных биотехнических систем для
ортопедической хирургии.
Литература
1. Патент РФ на изобретение №2412723. Способ получения оксидного биосовместимого покрытия на чрескостных имплантатах из нержавеющей стали / Родионов И.В., Бутовский К.Г., Анников В.В., Карпова А.И. Опубл. 27.02.2011.
2. Патент РФ на изобретение № 2472532. Остеоинтеграционное покрытие на ортопедические и
стоматологические титановые имплантаты / Родионов И.В. Опубл. 20.01.2013.
3. Fomin A.A., Rodionov I.V., Steinhauer A.B.,
Fomina M.A., Zakharevich A.M., Skaptsov A.A., Petrova N.V. Structure of
Composite Biocompatible Titania Coatings Modified with Hydroxyapatite
Nanoparticles // Advanced Materials Research, 2013. Vol. 787. pp. 376-381.
4. Фомин А.А., Штейнгауэр А.Б., Родионов И.В., Петрова
Н.В., Захаревич А.М., Скапцов А.А., Грибов А.Н. Наноструктура покрытий из
диоксида титана, модифицированного гидроксиапатитом, на медицинских титановых
имплантатах // Медицинская техника. №3 (279), 2013. С. 24-27.







