Е.А.
Дикусар, В.М. Зеленковский, А.Л. Пушкарчук, Д.А. Рудаков,
С.Я. Килин,
А.Г. Солдатов, А.В. Холопцев, Г.Ф. Батраков
Институт
физико-органической химии Национальной академии наук Беларуси
Институт
физики им. Б.И. Степанова Национальной академии наук Беларуси
Научно-производственный
центр Национальной академии наук Беларуси по материаловедению
Севастопольский
национальный технический университет
Морской гидрофизический институт Национальной
академии наук Украины
ЭНДОЭДРИЧЕСКИЕ РАДОН-222 СОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ БАКМИНСТЕРФУЛЛЕРЕНОВ С60
И С80 В КАЧЕСТВЕ НАНОРОБОТОВ-ИСТРЕБИТЕЛЕЙ ОПУХОЛЕВЫХ НОВООБРАЗОВАНИЙ
В последние десятилетия в онкологию успешно
внедряется новая технология лечения опухолевых
заболеваний – нейтрон-захватная терапия [1]. Эта технология разработана для
избирательного воздействия на злокачественные новообразования и является
бинарной, использующей тропные к опухолям препараты, содержащие нуклиды (B10, Cd113, Gd157 и
др.), которые, поглощая тепловые нейтроны, способны генерировать вторичное α-излучение,
губительное для целевых опухолевых клеток-мишеней и достаточно безопасное для
нормальных, здоровых органов и тканей. Ранее мы уже сообщали о перспективах
разработки B10- и Gd157-содержащих агентов для нейтрон-захватная терапии [2-5].
Существенным недостатком бор-, гадолиний-
и кадмийсодержащих препаратов для их широкого применения в нейтрон-захватной
терапии является довольно высокая общая токсичность этих соединений и их
недостаточная устойчивость к длительному воздействию биологических сред. Кроме
того, нейтрон-захватная терапия предполагает использование очень сложных,
дорогостоящих и не безопасных в обращении установок для генерации
узконаправленных пучков тепловых нейтронов [1].
Возможности создания
нанороботов-истребителей опухолевых новообразований на основе других
радионуклидов на данный момент изучены еще недостаточно [1]. Хотя ряд радиоактивных изотопов уже находят
применение в медицине, в частности, коллоидный Y90 с периодом
полураспада, равным 62 часам, избирательно накапливается в костной ткани, иприменяется
для лечения лейкемий и полицитемий и некоторых болезней печени и селезенки; Zr95
с периодом полураспада, равным 63 дням, применяется в тех же случаях, как и
радиоактивный иттрий, но с меньшим терапевтическим эффектом; Fe59 с
периодом полураспада, равным 45.5 дня, применяется для метки эритроцитов
(последние используются для изучения поведения эритроцитов при переливании
крови), можно при помощи радиоактивного железа также проследить, как синтезируется
в организме гемоглобин и с какой скоростью он образуется; радиоактивный тулий –
Tm170
с периодом полураспада, равным 127 дням, применяется
для гаммографии (снимка челюсти, кисти рук, зуба и т. д.); Еu155 с
периодом полураспада, равным 2 годам, используется для гаммографии. Тем не
менее, возможности производства подобных противоопухолевых препаратов с
использованием Rn222 ранее
не рассматривались. Вследствие этого их изучение представляет существенный
теоретический и практический интерес.
Радон Rn222 (III) широко
распространен в природе, а его добыча
технически легко осуществима [8-12]. При распаде Rn222 (III) происходит
испускание α-частиц с энергией
6.29 МэВ и γ-квантов с энергией 510 КэВ
( выход последних крайне незначителен и не превышает 0.07%). При этом
пробег α-частиц в воздухе
составляет около 4.5.10-6 см, а в мягких биологических тканях – около 50 мкм, полная
ионизация на всем пути ее пробега составляет 1.6.105 пар ионов [13], что вполне достаточно для
полного уничтожения опухолевых новообразований без повреждения прилегающих
здоровых тканей и органов [1, 6].
Природный радон в виде радоновых ванн,
широко используется в медицине и бальнеологии для наружного применения [9].
Период полураспада Rn222 (III) составляет
3.823 дня, константа распада λ
2.0974.10-6 с, среднее время жизни τ 0.477.10-6 с (5.52 дня). Радон Rn222 (III) входит в
радиоактивный ряд урана U238 и при своем естественном распаде образует ряд
короткоживущих, преимущественно α-излучающих
радионуклидов (Po218, Pb210, Po210), распад которых завершается образованием стабильного
нуклида Pb216 [8, 13-20].
Впервые сведения об эндоэдрических
бакминсерфуллереновых нанокластерах, содержащих супрамолекулярные объекты
включения, появились еще в 1985 г. – сразу после открытия самих
бакминсерфуллеренов. Содержание этих соединений в синтезированной саже,
полученной действием электродугового разряда с использованием графитовых
электродов в присутствии эндоэдрического компонента включения, обычно не
превышало 1-2%, и для получения их в индивидуальном состоянии применяли высокоэффективную
препаративную жидкостную хроматографию [7].
Можно предположить, что отдача дочерних
ядер (Po218, Pb210, Po210 и Pb216) после
испускания α-частиц будет
недостаточной для их выхода из бакминстерфуллереновой клетки [18, 20], и это
позволит удалять отработанные нуклиды из организма в виде их эндоэдрических
бакминсерфуллереновых нанокластеров.
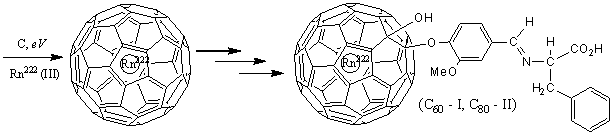
В качестве производных
бакминстерфуллеренов С60 и С80, ковалентно связанных с
тропными к опухолевым клеткам экзо-заместителями
(I, II), могут
выступать производные аминокислоты фенилаланина (L-α-амино-β-фенилпропионовой кислоты),
присоединенные к бакминстерфуллереновому фрагменту с помощью азометинового
ванилинового линкера [21-25]. Из литературных источников известно, что L-фенилаланин
участвует в метаболизме опухолевых клеток и накапливается при росте
злокачественных новообразований [1, 26-28]. Синтез хиральных ванилиновых
производных L-фенилаланина детально изучен нами в работе [29].
Методы химической модификации бакминстерфуллеренов
достаточно хорошо разработаны и позволяют целенаправленно получать их
производные с заранее заданной аутентичной структурой [30-34]. Так как период
полураспада Rn222 составляет
всего 3.823 дня, а среднее время жизни – 5.52 дня, необходимо разработать такую
экспресс-технологию получения эндоэдрических радонсодержащих соединений,
которая позволит их использовать в терапии онкологических заболеваний до
наступления естественной дезактивации.
Литература
1. Hosmane N.S., Maquire J.A., Zhu Y. Boron and
Gadolinium Neutron Capture Therapy for Cancer Treatment. World Scientific
Publishing Co. Pte. Ltd., 2012. 300 p.
2. Дикусар Е.А., Зеленковский В.М.,
Поткин В.И., Юдин А.А. // Теорет. и эксперим. химия. 2010. Т. 46. № 4. С.
208-211.
3. Дикусар Е.А., Зеленковский В.М.,
Поткин В.И. // Фуллерены и
наноструктуры в конденсированных средах: сб. науч. ст. / редкол.: П.А. Витязь
(отв. ред.) [и др.]. Минск: Изд. центр БГУ, 2011. С. 56-61.
4. Дикусар Е.А., Зеленковский В.М.,
Поткин В.И., Рудаков Д.А. // Химические реактивы, реагенты и процессы
малотоннажной химии: сб. науч. тр. / Нац. акад. наук Беларуси, Ин-т химии новых
материалов; науч. ред. В.Е. Агабеков, Е.В. Королева, К.Н. Гусак. Минск:
Беларус. навука, 2011. С. 133-140.
5. Dikusar E.,
Zelenkovski V., Potkin V., Rudakov D., Puskarchuk A., Soldatov A. // Nonlinear
Phenomena in Complex Systems. 2011. Vol. 14. No. 4. P. 356-362.
6. Nanomaterials for Cancer Therapy / Ed. C.S.S. Kumar.
Weinheim: Wiley-VCH, 2006. 145 p.
7. XI International Conference «Hydrogen Materials Sciece
and Chemistry of Carbon Nanomaterials (ICHMS’2009)». / Ed.: D.V. Schur, S.Yu. Zaginaichenko,
T.N. Veziroglu, V.V. Skorokhod. 25-31 августа 2009 г. Yalta, Crimea, Ukraine. Kiev:
AHEU, 2009.
8. Батраков Г.Ф. Радиоактивные изотопы в атмосфере и
океане. Севастополь: НПЦ «ЭКОСИ-Гидрофизика», 2012. 378 с.
9. Гудзенко В.В., Дубинчук В.Т. Изотопы радия и радона
в природных водах. М.: Наука, 1987. 157 с.
10. Дрожжин В.М., Николаев Д.С., Лазарев С.Ф., Ефимова
Е.И., Нечай Г.Н. // Радиохимия. 1966. № 4. С. 442-449.
11. Сердюкова А.С., Капитанов Ю.Т. Изотопы радона в
природе. М.: Атомиздат, 1975. 295 с.
12. Синьков С.И. Поведение короткоживущих продуктов
распада радона в приводной атмосфере. // Автореф. дисс…к.х.н. М.: МГУ им. М.В.
Ломоносова, 1990.
13. Перлман И., Расмуссен Д. Альфа-радиоактивность.
М., 1959.
14. Моисеев А.А., Иванов В.И. Краткий справочник по
радиационной защите и дозиметрии. М.: Атомиздат, 1964. 182 с.
15. Старик И.Е. Основы радиохимии. Л.: Наука, 1969.
647 с.
16. Гольданский В.И., Лейкин Е.М. Превращения атомных
ядер. М., 1958.
17. Горшков Г.В. Проникающее излучение радиоактивных
источников. Л.: Наука, 1967. 352 с.
18. Джелепов Б.С., Пекар Л.К. Схемы распада
радиоактивных ядер. М.: Наука, 1966. 749 с.
19. Сапожников Ю.А., Алиев Р.А., Калмыков С.Н.
Радиоактивность окружающей среды. М.: БИНОМ, Лаборатория знаний, 2006. 286 с.
20. Селинов И.П. Изотопы. М.: Наука, 1970. 624 с.
21. Дикусар Е.А., Козлов Н.Г., Тлегенов Р.Т.,
Утениязов К.У. Азометины на основе ванилина и ванилаля. Нукус: «Каракалпакстан»,
2007. 207 с.
22. Дикусар Е.А., Козлов Н.Г., Поткин В.И., Тлегенов
Р.Т. Азотсодержащие синтоны ванилинового ряда в органичексом синтезе.
Получение, применение, биологическая активность. В 2-х книгах. Кн. 2. Нукус:
«Билим», 2010. 226 с.
23. Дикусар Е.А., Козлов Н.Г.,
Поткин В.И., Ювченко А.П., Тлегенов Р.Т. Замещенные бензальдегиды ванилинового
ряда в органическом синтезе: получение, применение, биологическая активность.
Минск: Право и экономика, 2011. 446 с.
24. Дикусар Е.А., Поткин В.И.,
Козлов Н.Г. Бензальдегиды ванилинового ряда. Синтез производных, применение и
биологическая активность. Saarbrücken, Germany: LAP
LAMBERT Academic Publishing GmbH & Co. KG, 2012. 612 c.
25. Дикусар Е.А., Поткин В.И., Козлов Н.Г., Тлегенов Р.Т.
Функционально-замещенные производные ванилина. // Весцi НАН Б. Сер. хiм. навук. 2011. № 4. С. 105-120.
26. Кочетков Н.К., Торгов И.В.,
Ботвинник М.М. Химия природных соединений. М., 1961.
27. Штрауб Ф.Б. Биохимия. Будапешт,
1963.
28. Майстер М. Биохимия
аминокислот. М., 1961.
29. Дикусар Е.А. // ЖОрХ. 2011. Т. 47.
Вып. 2. С. 213-216.
30. Hirsch A.,
Brettreich M. Fullerenes: Chemistry and Reactions. Wienheim: Wiley-VCH, 2005.
31. Fullerenes: from
Synthesis to Optoelectronic Properties. / Ed. D.M. Guldi and N. Martin.
Dorddrecht: Kluwer Academic Publishers, 2003. 664 p.
32. Fullerenes:
Chemistry, Physics and Technology. / Ed. K.M. Kadish and R.S. Ruoff. N.-Y.: John Wiley & Sons, Inc., 2000. 968 p.
33. Djordjevic
A., Vojinovic-Miloradov M., Petranovic N., Devecerski A., Lazar D., Ribar B. //
Fullerene Science and Technol. 1998. Vol. 6. N. 4. P. 689-654.
34. Титце Л., Айхер Т. Препаративная
органическая химия. М.: Мир, 1999. С. 437-438.