Береснев А.И.1, Квач С.В.1,
Сивец Г.Г.2, Зинченко А.И.1
1Институт микробиологии НАН Беларуси, Минск
2Институт
биоорганической химии НАН Беларуси, Минск
ПОЛУЧЕНИЕ
МОДИФИЦИРОВАННЫХ НУКЛЕОЗИДОВ С ИСПОЛЬЗОВАНИЕМ ФЕРМЕНТОВ МИКРООРГАНИЗМОВ
Все чаще появляются опубликованные работы,
описывающие технологии получения новых представителей класса модифицированных
нуклеозидов, находящих широкое применение при терапии злокачественных
новообразований и вирусных инфекций. Каноническими методами синтеза
модифицированных нуклеозидов считаются химические. Однако в последние годы
преобладают публикации, описывающие синтез модифицированных
нуклеозидов с использованием ферментов микроорганизмов.
Традиционными биокатализаторами, использующимися
для ферментативного синтеза модифицированных нуклеозидов, служат
нуклеозидфосфорилазы, катализирующие расщепление молекулы нуклеозида в
присутствии неорганического фосфата (Рi) на азотистое основание и α-D-пентофуранозо-1-фосфат [1].
Ранее нами, а также другими авторами
[2, 3], описан сконструированный генно-инженерный штамм Escherichia coli, продуцирующий
рекомбинантную пиримидиннуклеозидфосфорилазу (ПирНФаза) Thermus thermophilus. Показано,
что, в отличие от широко использующихся для ферментативного синтеза модифицированных
нуклеозидов тимидинфосфорилазы и уридинфосфорилазы E.
coli, ПирНФаза
способна использовать в качестве субстратов модифицированные нуклеозиды,
содержащие атом фтора в углеводной части. Мы считаем, что использование ПирНФазы
T. thermophilus в паре с
пуриннуклеозидфосфорилазой (ПурНФаза) E.
coli, созданной
ранее в нашей лаборатории [4], позволит получать труднодоступные фторсодержащие
пуриновые модифицированные нуклеозиды.
Целью данной работы явилось проверка
способности ПирНФазы T. thermophilus катализировать
фосфоролиз 3'-фтор-3'-дезоксиксилофуранозилурацила (3'-F-3'-dxyloU) и 3'-фтор-3'-дезокситимидина
(3'-F-3'-dThd), а также синтез различных представителей класса модифицированных
нуклеозидов с использованием рекомбинантных ПирНФазы T. thermophilus и ПурНФазы E. coli.
Объекты и методы
исследования.
В работе использовали рекомбинантные гомологичные УРФазу, ТФазу и ПурНФазу E. coli,
а также рекомбинантную гетерологичную ПирНФазу T. thermophilus.
Реакцию фосфоролиза 3'-F-3'-dxyloU и 3'-F-3'-dThd изучали в присутствии ПирНФазы,
ТФазы и УРФазы: к растворам, содержащим
10 мМ 3'-F-3'-dxyloU и 10 мМ 3'-F-3'-dThd в 50 мМ калий-фосфатном буфере, рН
7,0 (КФБ) добавляли по 2,5 ед/мл каждого из ферментов. Реакционные смеси,
содержащие ПирНФазу, инкубировали при 80 °С в течение 72 ч, а реакционные
смеси, содержащие ТФазу и УРФазу, инкубировали при 40 °С в течение 72 ч.
Энзиматический синтез пуриновых 3'-фтор-3'-дезокси-β-D-рибо- и -ксилонуклеозидов осуществляли из 3'-F-3'-dxyloU и 3'-F-3'-dThd. Реакции проводили
в 5 мМ КФБ и температуре 60 °С в течение 5 дней, и реакционные смеси имели
следующий компонентный состав: (1) – 15 мМ 3'-F-3'-dxyloU, 10 мМ
аденин (Ade), 20 ед/мл ПирНФазы, 200 ед/мл
ПурНФазы; (2) – 15 мМ 3'-F-3'-dxyloU, 10 мМ 2-аминоаденин (2NH2-Ade), 20 ед/мл ПирНФазы, 200 ед/мл
ПурНФазы; (3) – 15 мМ 3'-F-3'-dThd, 10 мМ Ade, 20 ед/мл ПирНФазы, 200 ед/мл ПурНФазы; (4) – 15 мМ 3'-F-3'-dThd, 10 мМ 2NH2-Ade, 20 ед/мл ПирНФазы, 200 ед/мл ПурНФазы.
Контроль накопления целевых продуктов проводили путем тонкослойной
хроматографии на пластинах Silica gel 60F254 (Merck, Германия) в системе растворителей
изопропанол‒хлороформ‒29%-ный водный аммиак в соотношении 10:10:1
(по объему). Расположение пятен субстратов и продуктов на хроматографической
пластине регистрировали в ультрафиолетовом свете, после чего вещества из пятен
элюировали в 10 мМ КФБ. Концентрацию продуктов в элюатах определяли с помощью
спектрофотометрии, используя известные коэффициенты молярной экстинкции.
Спектры поглощения записывали на регистрирующем спектрофотометре UV-1202 фирмы «Shimadzu» (Япония).
Структуры синтезированных нуклеозидов подтверждали сравнением данных
ТСХ и УФ-спектроскопии с образцами известных пуриновых
3′-фторнуклеозидов, полученных ранее химическими методами, а в отдельных
случаях ‒ спектральными данными 1H ЯМР-, УФ- и масс-спектроскопии.
Приведенные
в работе экспериментальные данные представляют собой доверительные интервалы
среднего арифметического для 95%-ного уровня вероятности.
Результаты и
их обсуждение. На первом этапе работы установлена способность ПирНФазы T. thermophilus, ТФазы E.
coli и УРФазы E.
coli катализировать реакцию фосфоролиза 3'-F-3'-dxyloU и 3'-F-3'-dThd (рисунок 1).
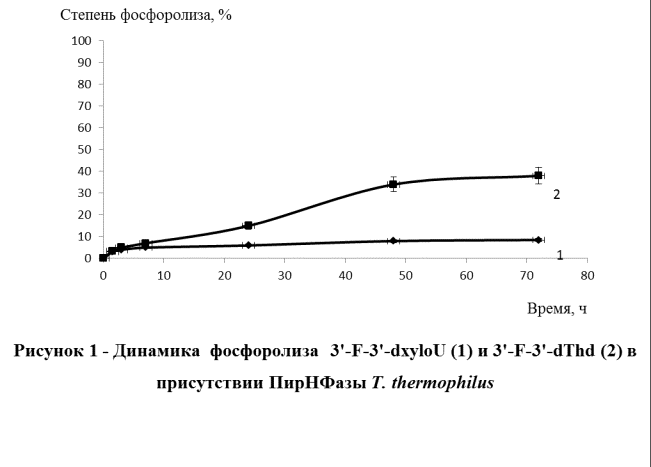
Установлено, что степень фосфоролиза 3'-F-3'-dxyloU и 3'-F-3'-dThd в реакционных
смесях, содержащих ПирНФазу, за 72 ч протекания реакции достигла 10 % и 38 %
соответственно. В свою очередь показано, что ТФаза и УРФаза не способны
использовать в качестве субстратов 3'-F-3'-dxyloU и 3'-F-3'-dThd. Принимая
во внимание полученные результаты, а также данные ранее опубликованных работ [2, 5], где в результате проведенных экспериментов установлено,
что ТФаза и УРФаза E. coli не
катализируют фосфоролиз 3'-фтор-2',3'-дидезокситимидина, можно предположить,
что наличие атома фтора в С3'-положении пиримидиновых нуклеозидов приводит к
полной потере субстратных свойств этих соединений для ТФазы и УРФазы.
Ферментативный
синтез 3-α-фторпуриновых нуклеозидов, осуществляли из пиримидиновых
нуклеозидов (3′-F-3′-dxyloU и 3′-F-3′-dThd) и
пуриновых гетероциклических оснований (Ade, 2NH2-Ade) в присутствии рекомбинантных ПирНФазы T. thermophilus и ПурНФазы E. coli. В результате выполнения экспериментов
получены следующие пуриновые модифицированные нуклеозиды:
3'-фтор-3'-дезокси-2-аминоксилофуранозиладенин (3′-F-3′-d-2NH2-xyloA), 3'-фтор-3'-дезоксиаденозин (3′-F-3′-dAdo), 3'-фтор-3'-дезокси-2-аминоаденозин (3′-F-3′-d-2NH2-Ado). Компоненты ферментативных реакций и выход
целевых нуклеозидов представлены в таблице 1.
Таблица 1
Синтез
модифицированных нуклеозидов
|
№ реакционной смеси |
Продукт |
Донор углеводного фрагмента (15 мМ) |
Акцептор (10 мМ) |
Выход продукта, мол.% |
|
1 |
3'-фтор-3'-дезокси-ксилофуранозиладенин
(3′-F-3′-dxyloA), |
3′-F-3′-dxyloU |
Ade |
0 |
|
2 |
3′-F-3′-d-2NH2-xyloA |
3′-F-3′-dxyloU |
2NH2-Ade |
12±1 |
|
3 |
3′-F-3′-dAdo |
3′-F-3′-dThd |
Ade |
44±3 |
|
4 |
3′-F-3′-d-2NH2-Ado |
3′-F-3′-dThd |
2NH2-Ade |
51±3 |
Следует отметить, что в реакционной смеси, содержащей в качестве
субстратов Ade и 3′-F-3′-dxyloU, не
наблюдается образования целевого продукта.
Таким образом, в ходе выполнения экспериментов впервые с использованием
ферментов синтезированы 3′-F-3′-d-2NH2-xyloA, 3′-F-3′-dAdo, 3′-F-3′-d-2NH2-Ado. Продемонстрированные в работе результаты
ферментативного синтеза фторированных модифицированных нуклеозидов могут лечь в
основу разработки препаративных технологий биотехнологического получения фармакологически
перспективных пуриновых 3′-фторсодержащих нуклеозидов.
Литература:
1. Mikhailopulo I.A., Miroshnikov A.I. Biologically
important nucleosides: modern trends in biotechnology and application //
Mendeleev Commun. 2011. Vol. 21. P. 57–68.
2.
Beresnev A.I., Kvach S.V., Sivets G.G., Zinchenko A.I. Enzymatic synthesis of
3'-fluoro-2',3'-dideoxyguanosine // Dny
vedy – 2013:
materialy IX Mezinarodni vedecko-prakticka
konference, Praha, 27.03–05.04.2013 /
red. Z. Cernak. Praha, 2013. Vol. 30. P.
51–54.
3. Szeker K.,
Zhou X., Schwab T. et al. Comparative investigations on thermostable
pyrimidine nucleoside phosphorylases from Geobacillus
thermoglucosidasius and Thermus
thermophilus // J. Mol. Catal. B: Enzym. 2012. Vol.
84. P. 27–34.
4. Квач С.В., Шахбазов А.В., Зинченко А.И., Картель Н.А. Суперпродукция
пуриннуклеозидфосфорилазы
Escherichia coli в
pET/Bl21 системе // Микробная биотехнология: фундаментальные и прикладные аспекты: сб. науч. тр. Т. 1; под ред. Э.И. Коломиец и А.Г. Лобанка.
Минск, 2007. С. 117–124.
5. Береснев А.И., Квач С.В., Сивец Г.Г., Зинченко А.И. Синтез
3'-фтор-2',3'-дидезоксигуанозина // Микробная биотехнология: фундаментальные и прикладные
аспекты: сб. науч. тр. Т. 5; под ред. Э.И. Коломиец и А.Г. Лобанка. Минск, 2013.
С. 19–29.