Ерошевская Л.А.1,
Лузина Е.Б.1, Рымко А.Н.1, Василькевич
А.И.2,
Кисель М.А.2,
Зинченко А.И.1
1Институт
микробиологии НАН Беларуси, Минск, Беларусь
2Институт биоорганической химии НАН Беларуси, Минск
Синтез
фосфатидилкинетинрибозида с
использованием
микробной фосфолипазы D
Кинетин
представляет собой N6-модифицированный пурин (N6-фурфуриладенин),
который был обнаружен как продукт деградации ДНК молок сельди, способный
стимулировать деление растительных клеток [1]. Какое-то время кинетин считался
неприродным (синтетическим) соединением, однако сравнительно недавно кинетин и
кинетинрибозид были найдены в млечном соке кокосового ореха [2]. Кинетин влияет
на рост листьев и созревание семян в процессе развития растений (что типично
для цитокининов) и проявляет ряд важных биологических активностей [3]. Кинетинрибозид
проявляет цитотоксическую активность в культуре клеток мышей, человека и опухолей
растений [4]. Его антипролиферативные и апоптозные эффекты на опухолевых
клетках человека также надежно документированы [5‒7].
Цитотоксические
эффекты кинетинрибозида обусловлены его способностью вызывать быстрое истощение
АТФ, приводя к генотоксическому стрессу, который активирует ген CDKN1A и другие ответственные за стресс гены [8]. Наконец, кинетинрибозид
идентифицирован в качестве терапевтического агента для терапии множественной
миеломы [9], острого миелобластного лейкоза [10] и рака прямой кишки [11].
Таким образом, кинетинрибозид играет важную роль при индукции клеточной гибели
у клеток различных типов опухолей и может рассматриваться в качестве
перспективного кандидата на статус противоопухолевого средства.
Одним из эффективных подходов к решению проблемы
транспорта нуклеозидов через гидрофобные липидные биологические
мембраны в клетку является химическая [12] или ферментативная (с помощью
микробной фосфолипазы D [13, 14]) модификация этих соединений фосфолипидами. Цель настоящего
исследования состояла в синтезе 5'-фосфатидилкинетинрибозида (ФКР; рис. 1) из
кинетинрибозида и фосфатидилхолина с помощью фосфолипазы D, изолированной из фильтрата КЖ Streptomyces netropsis БИМ В-428Д.
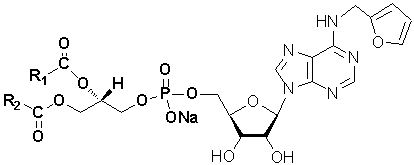
Рис. 1 Структурная формула
5′-фосфатидилкинетинрибозида.
Процедура получения фермента и определение его активности описаны
ранее [15]. Использованный в работе кинетинрибозид синтезировали методом
ферментативного трансгликозилирования, как было описано нами ранее [16]. Спектры поглощения записывали на регистрирующем
спектрофотометре UV-1202 фирмы «Shimadzu» (Япония).
На первом этапе работы был проведен анализ состава и
структуры продуктов, образующихся в ходе изучаемого ферментативного процесса.
На рис. 2 представлена хроматограмма реакционной смеси, из которой видно, что
ферментативный процесс сопровождается накоплением нового продукта. Его фосфолипидная
природа подтверждается окрашиванием пятна при обработке хроматограммы
специфическим реагентом на фосфолипиды [17]. В спектре поглощения продукта
после его выделения с помощью флэш-хроматографии наблюдается полоса поглощения
при 268 нм (этанол), характерная для гетероциклического основания кинетинрибозида
[18]. Соотношение содержания фосфора и хромофора в образующемся фосфолипиде
составляет 1:1.
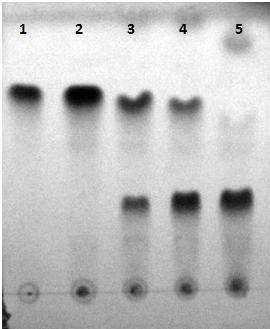
Рис. 2.
Тонкослойная хроматограмма кинетинрибозида (1) и реакционной смеси до (2) и
после синтеза ФКР в течение 0,5 (3), 8 (4)
и 17 (5) ч.
Проведенные эксперименты по частичной
оптимизации условий реакции трансфосфатидилирования позволили предложить
следующую методику синтеза ФКР. Реакционную смесь (14,4 мл), содержащую 50 мг (3,6
ммоль) кинетинрибозида, 9,65 мл хлороформа, 1,152 мл 2,5 М Na-ацетатного буфера (рН 6,0), 350 мг
фосфатидилхолина (выделен из желтка куриных яиц), 0,72 мл 2 М CaCl2 и 2,8 мл фильтрата культуральной жидкости, содержащего фосфолипазу
D, перемешивали при 37оС
в течение 18 ч. Выход реакции синтеза ФКР составил >95 мол.%. Целевой продукт
из конечной реакционной смеси изолировали, используя методику, описанную в
работе [15]. Структура целевого продукта доказана на основании анализа данных
ТСХ, УФ-спектроскопии.
Таким образом, в настоящей работе экспериментально
обоснована возможность использования препарата фосфолипазы D S. netropsis для
препаративного синтеза коньюгата фосфолипида с фармакологически перспективным
нуклеозидом – кинетинрибозидом. Имеются основания полагать, что такая депонированная
форма кинетинрибозида будет способствовать его стабильности в русле крови и
повышению адресности доставки в клетки-мишени.
Литература:
1. Miller C.O., Skoog F., Von Saltza M.H.,
Strong F.M. Kinetin: a cell division factor from deoxyribonucleic acid // J.
Am. Chem. Soc. 1955. Vol. 77. P. 1392–1393.
2. Ge L., Yong J.W.H., Goh N.K. et al. Identification of kinetin and kinetin riboside in coconut
(Cocos nucifera L.) water using a combined approach of liquid
chromatographytandem mass spectrometry, high performance liquid chromatography
and capillary electrophoresis // J. Chromatogr. B. 2005. Vol. 829. P. 26–34.
3. Barciszewski J., Massino F., Clark B.F.C.
Kinetin: a multiactive molecule // Int. J. Biol. Macromol. 2007. Vol. 40. P.
182–192.
4.
Griffaut B., Bos R., Maurizis J.C. et al. Cytotoxic effects of kinetin riboside
on mouse, human and plant tumour cells // Int. J. Biol. Macromol. 2004. Vol.
34. P. 271–275.
5. Orr M.F., McSwain B. The effect of kinetin,
kinetin ribofuranoside and gibberellic acid upon cultures of skin and mammary
carcinoma and cystic disease // Cancer Res. 1960. Vol. 20. P. 1362–1364.
6. Choi B.H.; Kim W.; Wang Q.C. et al. Kinetin
riboside preferentially induces apoptosis by modulating Bcl-2 family proteins
and caspase-3 in cancer cells // Cancer Lett. 2008. Vol. 261. P. 37–45.
7. Cheong J., Goh D., Yong J.W.H. et al.
Inhibitory effect of kinetin riboside in human heptamoa, HepG2 // Mol. Biosyst.
2009. Vol. 5. P. 91–98.
8. Cabello C.M.; Bair W.B., Ley S. et al. The
experimental chemotherapeutic N 6-furfuryladenosine (kinetin-riboside) induces
rapid ATP depletion, genotoxic stress, and CDKN1A (p21) upregulation in human
cancer cell lines // Biochem. Pharmacol. 2009. Vol. 77. P. 1125–1138.
9.
Tiedemann R.E., Mao X., Shi C.X. et al. Identification of kinetin riboside as a repressor of CCND1 and CCND2 with
preclinical antimyeloma activity // J. Clin. Invest. 2008. Vol. 118. P.
1750–1764.
10. McDermott S.P., Eppert K., Notta F. et al. A small molecule screening strategy with validation on
human leukemia stem cells uncovers the therapeutic efficacy of kinetin riboside
// Blood. 2012. Vol. 119, N 5. P.
1200−1207.
11. Rajabi M.,
Gorincioi E., Santaniello E. Antiproliferative activity of kinetin riboside on
HCT-15 colon cancer cell line // Nucleosides, Nucleotides, Nucleic Acids. 2012.
Vol. 31, N 6. P. 474–481.
12. Alexander R.L., Kucera G.L. Lipid nucleoside
conjugates for the treatment of cancer // Curr.
Pharm. Des. 2005.
Vol. 11, N 9. P. 1079–1089.
13. Shuto S., Ueda
S., Immamura S. et al. A facile one-step synthesis of
5′-phosphatidylnucleosides by an enzymatic two-phase reaction //
Tetradron Lett. 1987. Vol. 28, N 2. P. 199–202.
14. Биричевская Л.Л., Ерошевская Л.А.,
Кисель М.А., Зинченко А.И. Субстратные требования фосфолипазы D из Streptomyces
netropsis при синтезе фосфолипидов по реакции трансфосфатидилирования
// Химия природных соединений. 2006. №
1. С.
26–29.
15. Биричевская Л.Л.,
Хайкина Д.Б., Квач С.В. и др. Синтез 5' фосфатидилрибавирина с использованием микробной фосфолипазы D // Naukowa przestrzen Europy-2011: materialy VII miedzynarodowej naukowi-praktycznej konferencji, Przemysl, 07–15 kwietnia 2011 – V. 21. – S. 54–57.
16. Береснев А.И., Ерошевская Л.А. Квач С.В., Зинченко А.И. Синтез кинетинрибозида с использованием бактериальной пуриннуклеозидфосфорилазы // Весцi НАН Беларусi. Сер. бiял. навук. 2013. № 3. С. 73–77.
17. Vaskovsky V.E. Kostetsky E.Y., Vasendin I.M. An
universal reagent for phospholipid analysis // J. Chromatogr. 1975. Vol. 114, N
1. P. 129–141.
18. Kissman H.M., Weiss M.J. Kinetin riboside and
related nucleosides // J.
Org. Chem. 1956. Vol. 21, N 9. P. 1053−1055.