Щеколова А.С., Рымко А.Н., Квач С.В., Зинченко
А.И.
Институт микробиологии НАН Беларуси, Минск
ПОЛУЧЕНИЕ И ХАРАКТЕРИСТИКА
НАНОРАЗМЕРНЫХ КОМПЛЕКСОВ СЛОИСТЫХ ДВОЙНЫХ ГИДРОКСИДОВ,
СОДЕРЖАЩИХ CPG-ДНК И ЦИКЛО-ДИГМФ
CpG-мотивы представляют собой
олигодезоксинуклеотидные последовательности, содержащие в своей центральной
части CpG-динуклеотид. Было показано, что ДНК бактерий, содержащая
неметилированные CpG-мотивы, распознается иммунной системой позвоночных и
вызывает активацию врожденного иммунитета [1]. Препараты на основе плазмидной
ДНК, обогащенной CpG-мотивами (CpG-ДНК), являются перспективными для лечения бактериальных и вирусных инфекций, астмы, аллергий, некоторые виды опухолей, а также для
использования в качестве адъюванта для ряда вакцин [2].
Циклический 3′,5′-дигуанилат (цикло-диГМФ) выполняет
роль бактериального внутриклеточного вторичного посредника, вовлеченного в
регуляцию множества сложных физиологических процессов, таких как образование биопленок,
подвижность, адгезия, синтез экзополисахаридов, вирулентность и др. [3].
Недавние открытия показали, что данный циклический динуклеотид обладает
стимулирующими свойствами по отношению к иммунной системе позвоночных и может
быть использован в медицине в качестве терапевтического средства и адьюванта
для вакцин [4].
Серьезной проблемой применения
данных соединений является их низкая стабильность в русле крови. Для
преодоления этой трудности предложены различные наночастицы-переносчики. Среди
них наиболее перспективными считаются наноразмерные неорганические слоистые
двойные гидроксиды (СДГ). Эти наночастицы характеризуются низкой токсичностью,
высокой емкостью и повышенной способностью проникать в клетки, а также
способностью высвобождать переносимые соединения при пониженных значениях рН,
соответствующих рН внутри эндосом/лизосом [5].
Целью настоящей работы явилось
получение наночастиц на основе слоистых двойных гидроксидов магния и алюминия,
содержащих CpG-ДНК и цикло-диГМФ, и изучение возможности pH-зависимого высвобождения данных
соединений из нанокомплексов.
Материалы и методы. Синтез комплексов СДГ–CpG-ДНК и СДГ–цикло-диГМФ осуществляли методом соосаждения.
Для этого к 1,5 мл 0,1 М раствора NH4OH, содержащего 50 мкг CpG-плазмиды или 5 мг цикло-диГМФ, добавляли 500
мкл раствора, содержащего 0,02 М MgCl2 и
0,01 М Al(NO3)3. Старение полученных нанокомплексов проводили в
течение 12 ч при 75оС без доступа воздуха и при
интенсивном перемешивании. Эффективность интеркаляции плазмидной ДНК и
цикло-диГМФ в состав СДГ оценивали спектрофотометрически и с помощью электрофореза
в 1% агарозном геле.
Для элюции
соединений, комплекс осаждали центрифугированием 20 мин при 21 000 g и осадок ресуспендировали в дистиллированной воде или в
0,05 М фосфатно-цитратном буфере (рН 4,5 и 7,5). Элюцию проводили при 37оС. Степень элюции определяли по значению оптической плотности
супернатанта.
Обработку
ДНКазой I проводили следующим образом: 50 мкг плазмидной
ДНК или СДГ–CpG-ДНК
суспендировали в 100 мкл 10 мМ Tris-HCl, содержащего
2,5 мМ MgCl2 и 0,5 мМ
CaCl2,
добавляли 1 ед. активности ДНКазы и инкубировали в течение 1 ч при 37оС.
ДНК-азу инактивировали добавлением ЭДТА до 5 мМ с последующим прогреванием при
75оС в течение 15 мин.
Для
статистической обработки результатов рассчитывали доверительный интервал
среднего арифметического для 95%-го уровня вероятности. Для расчетов
использовалась компьютерная программа “Microsoft Exel”.
Результаты
и обсуждение. На первом этапе работы
получали нанокомплексы СДГ, содержащие CpG-ДНК и цикло-диГМФ. Степень включения гостевой
молекулы (лиганда) и другие характеристики полученных нанокомплексов
представлены в таблице 1.
Таблица 1
Характеристика
нанокомплексов
|
Лиганд |
Связывание, % |
Содержание, % |
Емкость |
||
|
мг лиганда/мг СДГ |
мг лиганда/мг комплекса |
мкмоль лиганда/мг СДГ |
|||
|
Цикло-диГМФ |
64,4±5,1 |
80,1±4 |
4,02±0,3 |
0,81±0,04 |
5,47±0,41 |
|
CpG-ДНК |
95±3,1 |
23,8±3 |
0,125±0,002 |
0,238±0,03 |
0,05±0,001 |
Из таблицы видно, что полученные
наноразмерные комплексы имеют высокую степень включения гостевой молекулы.
Кроме того, емкость СДГ в отношении плазмидной ДНК ниже, чем в отношении
цикло-диГМФ. Это может быть связано со стерическими особенностями
взаимодействия молекул.
Следующим
этапом исследования было изучение динамики элюции плазмидной ДНК и цикло-диГМФ
из комплекса с СДГ при различных значениях рН. Полученные данные отражены на
рисунке 1.
При постановке этого
эксперимента отмечено уменьшение, а затем и полное исчезновение, осадка СДГ при
инкубировании в фосфатно-цитратном буфере с рН 4,5, но не в дистиллированной
воде и в том же буфере с рН 7,5, что соответствует литературным данным [6].
Полученные результаты позволяют сделать предположение о том, что элюция
изучаемых соединений из комплекса с СДГ осуществляется за счет нескольких
механизмов: разрушения СДГ при кислых значениях рН и протекания ионообменной
реакции с замещением гостевой молекулы на неорганический фосфат, присутствующий
в буфере.
Анализ CpG-ДНК с помощью электрофореза
в агарозном геле (рисунок 2) показал, что плазмидная ДНК иммобилизуется в СДГ и
элюируется из данных наночастиц в неизмененной форме.
2 А 1 3
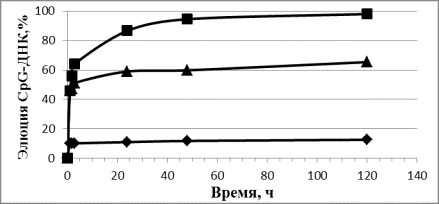
1 Б 2 3
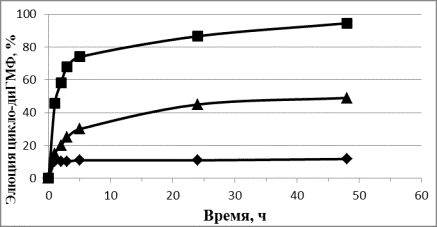
Рис. 1. Динамика элюции CpG-ДНК (А) и цикло-диГМФ (Б)
из комплекса с СДГ в воду (1), буфер pH 7,5 (2) и буфер pH 4,5
(3).
![]()
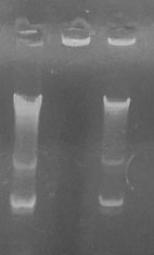
Рис.
2. Электрофореграмма CpG-ДНК до
включения в СДГ (1), после включения в
комплекс с СДГ (2) и после
элюции из комплекса с СДГ (3).
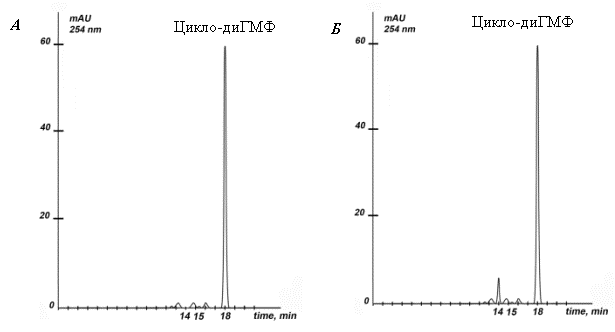 Хроматограмма цикло-диГМФ до и после элюции из
комплекса с СДГ (рисунок 3) также позволяет сделать вывод о том, что с
молекулами цикло-диГМФ не происходит никаких структурных изменений.
Хроматограмма цикло-диГМФ до и после элюции из
комплекса с СДГ (рисунок 3) также позволяет сделать вывод о том, что с
молекулами цикло-диГМФ не происходит никаких структурных изменений.
Рис.
3. Электрофореграмма цикло-диГМФ до включения в СДГ (А) и после элюции из
комплекса с СДГ (Б).
Для проверки способности СДГ защищатьCpG-ДНК от действия нуклеаз, CpG-ДНК и нанокомплекс СДГ–CpG-ДНК обрабатывали ДНКазой I. Полученные данные представлены на
рисунке 4.
Из электрофореграммы видно, что свободная
плазмидная ДНК деградирует полностью в описанных выше условиях, в то время как
ДНК, иммобилизованная в СДГ, частично защищена от действия нуклеазы. Таким
образом, иммобилизация CpG-ДНК в СДГ может в значительной степени повысить стабильность
препарата на основе CpG-ДНК в русле крови.
В ходе проделанных экспериментов были
впервые получены устойчивые комплексы СДГ с CpG-ДНК и цикло-диГМФ. Изучена динамика элюции плазмидной
CpG-ДНК и цикло-диГМФ из комплексов с СДГ при различных
значениях рН. Показано, что структура соединений после их включения в нанокомплекс
и элюции из СДГ не изменяется. Кроме того, продемонстрирована способность СДГ
частично защищать плазмидную ДНК от действия нуклеаз.
![]()
2000 п.о. 3000 п.о. 6000 п.о.
![]()
![]()
![]()
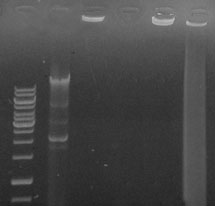
Рис. 4. Электрофореграмма
CpG-ДНК:
интактной (1), после обработки ДНКазой (3), в комплексе с СДГ (2), в комплексе
с СДГ после обработки ДНКазой (4), извлеченной из комплекса СДГ после обработки
ДНКазой.
М – маркер
молекулярных масс фрагментов ДНК
Литература:
1.
Krieg A.M. CpG motifs in bacterial
DNA and their immune effects / A.M. Krieg // Annu. Rev. Immunol. 2002. Vol. 20.
P. 709–760.
2.
Gupta G.K., Agrawal D.K. CpG oligodeoxynucleotides
as TLR9 ago-nists: therapeutic application in allergy and asthma // Biodrugs.
2010. Vol. 24. P. 225–235.
3.
Zahringer F., Massa C.,
Schirmer T. Efficient enzymatic production of the bacterial second messenger
c-di-GMP by the diguanylatecyclase YdeH from Escherichia coli // Appl. Biochem. Biotechnol. 2011. Vol. 163. P.
71–79.
4.
ChenW., Lee R.K., Yan H. The
potential of 3′,5′-cyclic diguanylic acid (c-di-GMP) as an
effective vaccine adjuvant // Vaccine. 2010. Vol. 28, N 18. P. 3080–3085.
5.
Choi S.J., Oh J.M., Choy J.H. Anticancer
drug-layered hydroxide nanohybrids as potent cancer chemotherapy agents
// J. Phys. Chem. Solids. 2008. Vol. 69, N 5–6. P. 1528–1532.
6.
Tyner K.M., Schiffman S.R.,
Giannelis E.P. Nanobiohybrids as delivery vehicles for camptothecin // J.
Control. Rel. 2004. Vol. 95. P. 501–514.