К. ф.-м. н. Валуева С. В., Боровикова Л. Н., Суханова Т. Е.,
Соколова М. П., Кутин А. А.
Федеральное государственное
бюджетное учреждение науки Институт
высокомолекулярных соединений РАН, Санкт-Петербург, Россия
БИОГЕННЫЕ СЕЛЕНСОДЕРЖАЩИЕ НАНОСИСТЕМЫ НА ОСНОВЕ ПОЛИЭЛЕКТРОЛИТНЫХ КОМПЛЕКСОВ:
КИНЕТИЧЕСКИЕ, РАЗМЕРНЫЕ И СПЕКТРАЛЬНЫЕ
ХАРАКТЕРИСТИКИ
Известно, что биогенный
элемент - селен, входящий в состав пищевых продуктов, оказывает
антибластическое действие, а между содержанием селена во внешней среде и
частотой поражения населения злокачественными опухолями существует обратно
пропорциональная зависимость [1]. Известно также, что в условиях дефицита
селена наблюдается развитие миокардиодистрофии, атеросклероза, ишемической
болезни сердца, инфаркта миокарда и хронического гепатита различной этимологии
[2, 3].
Ввиду
того, что гибридные наносистемы обладают синергизмом свойств исходных
компонентов, в настоящей работе в качестве полимерных матриц, стабилизирующих
наночастицы аморфного селена, были взяты полиэлектролитные комплексы (ПЭК)
додецилсульфата натрия (ДСН) с катионным сополимером П(ВП-К) N-винилпирролидона (ВП) и N,N,N,N-триэтилметакрилоилоксиэтиламмоний
йодида (К), которые в зависимости от мольного соотношения заряженных субъединиц
g (g=ДСН/К) в комплексе проявляют различную биоактивность
[4]. Учитывая тот факт, что указанные выше ПЭК обладают мембранотропными
свойствами и резко увеличивают проницаемость липидных бислоев [5], они могут
повысить уровень активности селена.
Цель работы заключалась
в синтезе наночастиц нуль-валентного аморфного селена (Se0) в
водных растворах ПЭК при различной
величине g и изучении кинетических,
размерных и спектральных характеристик формирующихся наносистем.
Для
стабилизации наночастиц селена в работе использовали ПЭК при разном мольном соотношении заряженных субъединиц g: g=0.5 и 4.0, молекулярные массы ПЭК
составляли: Мw=117´103 (g=0.5) и Мw=385´103 (g=4.0). Массовое соотношение
(ν) селен/ПЭК варьировали в широком диапазоне от 0.025 до 0.2.
Измерения
оптической плотности проводились на спектрофотометре «Specord M40» (Карл Цейс Йена, Германия) в диапазоне длин волн
230 – 770 нм, с толщиной фотометрического слоя 1 см. Величины константы
скорости k* процесса самоорганизации
селенсодержащих наносистем представлены в таблице.
Расчет k* был проведен по формуле [6] k* = ln(Dk/(Dk – Di))/ti ,
где Dk –
оптическая плотность, характеризующая конец процесса (в нашем случае 24 часа), Di – оптическая плотность в данный момент времени ti. Для измерения рН (таблица 1) среды использовался
милливольтметр И-160МИ.
Таблица.
Кинетические и
структурно-морфологические характеристики наносистем ПЭК-Se0 при варьировании ν.
|
γ |
ν |
k* × 10 3,
с-1 |
pH |
Rh*, нм |
RПЭМ*,
нм |
|
0.5 |
0.025 |
0.30 |
5.09 |
90 |
65-90-сф. |
|
0.05 |
0.63 |
3.87 |
60 |
- |
|
|
0.1 |
0.90 |
3.78 |
40 |
- |
|
|
0.15 |
5.32 |
2.97 |
40 |
- |
|
|
0.2 |
5.33 |
3.33 |
60 |
- |
|
|
4.0 |
0.025 |
0.12 |
4.94 |
60 |
30-50-сф. |
|
0.05 |
0.36 |
4.29 |
65 |
- |
|
|
0.1 |
1.0 |
3.73 |
60 |
- |
|
|
0.15 |
5.25 |
3.04 |
60 |
- |
|
|
0.2 |
5.30 |
3.28 |
55 |
- |
Методом динамического светорассеяния (ДСР) [7]
определяли средние гидродинамические радиусы наноструктур Rh*
(таблица), которые рассчитывали из значений коэффицентов диффузии (D*) по
уравнению Эйнштейна – Стокса Rh* = kT/6πη0D* (η0 –
вязкость растворителя). Оптическая часть установки для измерения динамического
рассеяния света укомплектована гониометром ALV-SP (Германия) (источник света -
гелий-неоновый (He-Ne) лазер Spectra-Physics с длиной волны l = 632.8 нм, мощностью ~ 20 mV). Корреляционную
функцию интенсивности рассеянного света получали с помощью коррелятора Photo
Cor-FC с числом каналов 288 (изготовитель – ЗАО “Антекс”, Россия). Анализ
корреляционной функции осуществляли с
помощью программы обработки данных динамического светорассеяния Dynals (фирма
“Гелиос”, Россия).
Исследования методом просвечивающей электронной
микроскопии (ПЭМ) проводили на электронном микроскопе BS-500 (фирмы Tesla,
Чехия) при ускоряющем напряжении U = 60 кВ, в
диапазоне увеличений ×10000-30000. Перед исследованием раствор
наносистемы наносили на медную сеточку покрытую формваровой пленкой и сушили на
воздухе.
Константы
скорости k* для наносистем ПЭК-Se0 при g = 0.5 и 4.0 в условиях полного насыщения адсобционной емкости наночастиц селена
(ν = 0.1) [8] составили соответственно 0.9´10 –3 с-1
и 1.0´10 –3 с-1 (таблица 1, рис. 1), т.е. скорость реакции при
ν = 0.1 не зависит от g для использованных значений
g.
В тоже время для селенсодержащих наносистем на основе ВП-К и ДСН величина
константы скорости несколько меньше, чем для наносистем ПЭК-Se0 и
составляет соответственно 0.6´10 –3 с-1
и 0.7´10 –3 с-1 (рис. 1).
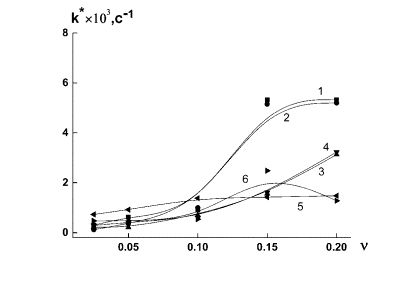
Рис. 1. Зависимость константы скорости образования k*наносистемы ПС - Se0 от ν
для различных полимерных стабилизаторов
(ПС):1 – ПЭК (γ = 0.5), 2 – ПЭК (γ = 4.0), 3 – ДСН, 4 – ПК, 5- ПВП*,
6 – ПДМАЭМ* (*- данные работы [9]).
Следует
отметить, что, несмотря на различия в строении и ММ всех исследованных полимерных стабилизаторов (ПС), константы
скорости k* слабо отличаются по величине
до точки ν < 0.1. После этой точки значения k* различны (рис. 1). Однако, если для ПЭК при γ =
0.5 и 4.0, величина константы скорости
сильно возрастает при ν ≥ 0.1, то для
остальных ПС (ПК, ДСН, ПВП, ПДМАЭМ, которые являются фактически компонентами
ПЭК), рост не столь значителен. Зависимости k*(ν) для ПВП-Se0 и ПДМАЭМ-Se0 были получены нами ранее в работе [9]. Кроме того,
несмотря на различие в составе и пространственной организации ПЭК при разных
значениях γ, величины k* практически совпадают. Это свидетельствует о том, что константа
скорости самоорганизации наносистемы является аддитивной величиной, зависящей
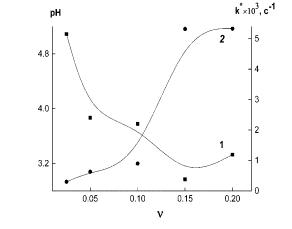
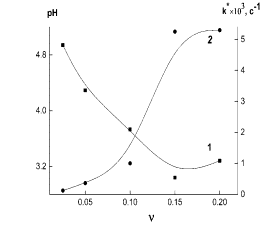
от структуры ПС и его ММ, а также параметров среды, например, pH. На рис.
2 приведены зависимости рН среды и k* от
массового соотношения селен/ПЭК, которые
демонстрируют антибатное
поведение этих параметров.
|
|
|
|
а) |
б) |
Рис. 2. Зависимости рН среды (1) и константы скорости k*образования наносистемы ПЭК - Se0 (2) от ν: а) – ПЭК при γ = 0.5, б) – ПЭК
при γ = 4.0.
Влияние pH среды на процесс образования
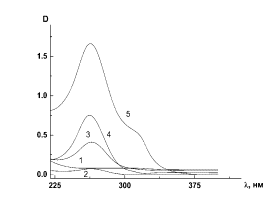
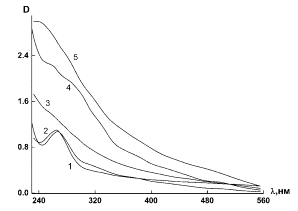
наночастиц Se0 четко прослеживается на спектрах поглощения
коллоидного селена при разных концентрациях селена, которые были сняты на
вторые сутки после получения коллоидного раствора (рис. 3а кривые 1-5). На спектрах при ν = 0.025 и 0.05
наблюдаются характерные пики при λ = 265 нм, что соответствует коллоидному
селену [10].
|
|
|
|
а) |
б) |
Рис. 3. Зависимость оптической плотности D от длины волны λ для коллоидного селена при
варьировании ν: 1 – 0.025; 2 – 0.05; 3 – 0.1; 4 – 0.15; 5 – 0.2 (а); для
коллоидного селена (cSe = 0.005%) при разных рН: 1 - 3.4: 2 - 3.8; 3 -4.4; 4 -
4.6; 5 - 4.8 (б).
Изменение спектральной
картины при варьировании pH проводили при
фиксированной концентрации растворов по селену cSe =
0.005%; рН среды изменяли предварительным введением в водный раствор гидроокиси
натрия. При увеличении рН среды от рН = 3.4 до 4.8 происходило значительное
увеличение времени стабильности коллоида - с 3-х до 6-и суток, а на зависимости
оптической плотности D от длины волны
λ при этом наблюдалось увеличение
интенсивности характерного для коллоидного селена пика при λмах
= 265 нм (рис. 3б).
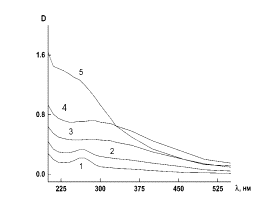
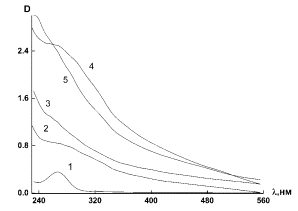
На рис. 4 а и б приведена
зависимость оптической плотности D от длины волны
λ для синтезированных наносистем ПЭК-Se0 при
варьировании ν. Как видно из рис. 4, кривые 1 и 2, полученные при γ =
0.5 и 4.0 различаются между собой по положению пика максимума поглощения и по
его амплитуде: так, при γ = 0.5 положение максимума соответствует λ =
266 нм, а при γ = 4.0 оно составляет
λ = 263 нм. Следует отметить, что при фиксированном ν величина рН
зависит от γ: рН = 5.09 (γ = 0.5) и 4.94 (γ = 4.0) при ν =
0.025; рН = 3.87 (γ = 0.5) и 4.29 (γ = 4.0) при ν = 0.05.
|
|
|
|
а) |
б) |
Рис. 4. Зависимость оптической плотности D от длины волны λ
для наносистемы ПЭК - Se0 при γ
= 0.5 (а) и при γ = 4.0 (б), где 1-ν = 0.025, 2 – ν = 0.05, 3 –
ν = 0.1, 4 – ν = 0.15, 5 – ν = 0.2.
Анализ данных рис. 1,
2, 4 и таблицы показывает, что
существует два диапазона значений ν (ν < 0.1 и ν ≥
0.1), которые существенно различаются по величине параметров k*, рН и по
спектральной картине. При возрастании ν от 0.025 до 0.1 для наносистем
ПЭК-Se0 при
γ = 0.5 наблюдается значительное (в 3 раза) увеличение значений k*, при
этом рН уменьшается. В этой области
также наблюдаются максимумы на зависимостях D(λ). При γ = 4.0 качественно картина такая
же, однако эффект увеличения k* от ν значительно более выражен. В области ν ≥ 0.1
при γ = 0.5 и 4.0 явных различий в указанных характеристиках не
наблюдается.
Оценка
гидродинамического радиуса Rh
наночастиц селена методом ДСР показала, что в отсутствие ПС образуются крупные
частицы с радиусом ~ 150 нм (при ν = 0.025), ~ 110 нм (при ν = 0.05),
~ 180 нм (при ν = 0.1), с узким унимодальным распределением по размерам.
По истечении двух суток происходит визуально видимая агрегация наночастиц
селена, выпадающих в осадок. При ν > 0.1 осадок наблюдается уже на
первые сутки. При использовании в качестве полимерного стабилизатора ПЭК, в
водных растворах формируются наноструктуры с размером < 100 нм (таблица) во
всем диапазоне варьирования ν; наносистемы характеризуются узким
унимодальным распределением по размерам и высокой стабильностью.
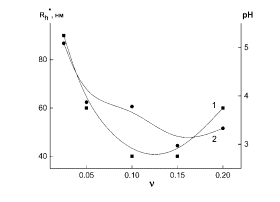
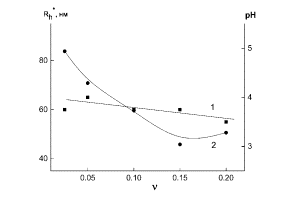
На рис. 5 (а, б) приведены зависимости гидродинамических радиусов Rh* (кривые
1) и рН среды (кривые 2) образующихся наносистем ПЭК-Se0 от
массового соотношения ν. Видно, что для наносистемы ПЭК-Se0 при
γ = 0.5 зависимость рН(ν) имеет убывающий характер, в то время как
зависимость Rh*(ν) проходит через минимум, соответствующий
«особой точке» при ν = 0.1 (рис. 5 а). При γ = 4.0 (рис. 5 б) зависимость Rh* от
ν очень слабо выражена, а зависимость рН(ν), как и в предыдущем
случае, имеет убывающий характер.
|
|
|
|
а) |
б) |
Рис. 5. Зависимости Rh* (1) и рН
среды (2) для наносистемы ПЭК - Se0от ν:
а) γ = 0.5, б) γ = 4.0.
Для выяснения деталей
морфологического строения наноструктур ПЭК–Se0 при
фиксированном ν и различных γ использовали метод ПЭМ. Поскольку
максимальные различия в физических параметрах наносистем в растворах
наблюдались в области ν < 0.1, для исследований методом ПЭМ были
выбраны наносистемы, синтезированные при минимальном массовом соотношении
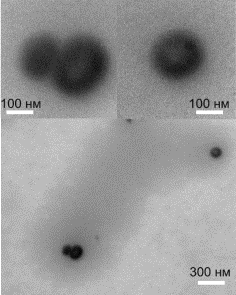
ν = 0.025. На микрофотографиях наносистемы ПЭК–Se0 при
γ = 0.5 (рис. 6а) наблюдаются
две популяции наноструктур – бинарные наноструктуры эллиптической формы с
максимальным размером ~ 300 нм и сферические одиночные наноструктуры радиусом RПЭМ* = 65-90
нм, имеющие уплотненный поверхностный слой толщиной порядка 40-50 нм.
Образовавшиеся наноструктуры погружены в полимерную матрицу (на
микрофотографиях она выглядит оптически более плотной, чем формваровая подложка
- серого цвета), образующую «островковую» пленку. При этом каждый «островок»
субмикронного размера содержит несколько селеновых наноструктур.
Для наносистемы ПЭК–Se0 с ν
= 0.025 при γ = 4.0 (рис. 6б)
на ПЭМ микрофотографиях видны однородные изолированные наноструктуры
сферической формы радиусом RПЭМ* = 30-50 нм. Наноструктуры окружены полимерной
матрицей, формирующей ореол вокруг каждой наноструктуры с радиусом порядка
100-120 нм.
|
|
|
|
а) |
б) |
Рис. 6. ПЭМ микрофотографии наносистемы ПЭК-Se0 при ν = 0.025:
а) γ = 0.5, б) γ = 4.0.
Таким
образом, с помощью комплекса физических методов показано, что гибридные
селенсодержащие наносистемы на основе
полиэлектролитных комплексов катионного сополимера N-винилпирролидона и N,N,N,N-триэтилметакрилоилоксиэтиламмоний
йодида с додецилсульфатом натрия при разном соотношении заряженных субъединиц
γ и разном содержании селена различаются по кинетическим (при ν < 0.1), размерным (Rh*, RПЭМ*) и спектральным параметрам. Показано, что структура
стабилизирующего полимера и концентрация реагентов в реакционной смеси являются
определяющими факторами для процесса формирования гибридных наноструктур и
оптимизации свойств наносистемы в целом.
Литература:
1.
Yoshizawa K., Willett W.C., Morris S.J. Study of prediagnostic selenium levels in toenails and the risc of
advanced prostate cancer// J. Natl. Cancer Inst. 1998. V. 20. P. 1219-1224.
2.
Абдуллаев Г.М., Зейналлы Э.М., Сафаров, Ю.И. Об изменениях концентрации селена при заболеваниях
гепатобилиарной системы// Врачебное дело.1978. №11. С.35-37.
3.
Yu, S.Y., Zhu, Y.J., Li, W.G.
Chemoprevention trial of human hepatitis with selenium supplementation in China
// Biol. Trace Element Res.1997.V. 51. № 1.P.117-124.
4.
Валуева С.В.,
Боровикова Л.Н., Волков А.Я. Биогенные
наноразмерные системы на основе наночастиц селена и полиэлектролитных
комплексов: самоорганизация, структура, термодинамика//Сборник статей по
материалам Международной научно-практической конференции «Дни науки». 27 марта - 5 апреля 2012. Прага, Чехия. с.
24-32.
5.
Копейкин В.В. Влияние
катионного полиэлектролита и полиэлектролитных комплексов додецилсульфата
натрия на проницаемость модельных фосфолипидных мембран// Биологич. мембраны.
1988. Т.5. № 7. С. 728-734.
6.
Березин И.В., Клесов А.А. Практический курс химической и ферментативной кинетики. М.: МГУ, 1976. 320 с.
7.
Brown W. Dynamic Light Scattering: the Method and Some Application. Oxford:
Clarondon Press, 1993. 305 p.
8.
Валуева С.В., Боровикова Л.Н., Киппер А.И. Влияние соотношения компонентов комплекса
селен:поливинилпирролидон на процесс формирования и морфологические
характеристики наноструктур// Журн. физ. химии. 2008. Т.82. №6. С.1131-1136.
9.
Валуева С.В., Вылегжанина М.Э., Лаврентьев В.К., Боровикова Л.Н., Суханова Т.Е. Биогенные наноразмерные системы на основе наночастиц
селена: самоорганизация, структура и морфология// Журн. физ. химии. 2013. Т.87. №3. с. 484-489.
10.
Калориметрические
(фотометрические) методы определения неметаллов / Под ред. Бусева А.И. М.: Иностран. литер., 1963.193 с.