К ВОПРОСУ О ПОВЫШЕНИИ БИОСОВМЕСТИМОСТИ
ИМПЛАНТАТОВ ДЛЯ ОСТЕОСИНТЕЗА
Е. Ю. Масленников1, Д. Е. Росторгуев1,
Е. А. Герасименко2
Кафедра военно-полевой хирургии Ростовского государственного медицинского
университета1; Институт аридных зон ЮНЦ РАН2.
Одной из причин развития осложнений при
оперативном лечении переломов является изменение биосовместимости имплантатов
для остеосинтеза при их длительном контакте с тканями организма [6,12,17].
Регресс биосовместимости может быть причинно
обусловлен изменением объёмных и поверхностных свойств имплантатов под влиянием
агрессивных биологических сред [10,11].
Одним из путей
профилактики постимплантационных осложнений является нанесение на поверхности
имплантатов для остеосинтеза специальных покрытий с целью повышения их
совместимости с биологическими тканями [5,9].
Для нанесения покрытий используются такие
методы, как плазменное напыление, электрохимическое оксидирование, золь-гель
технологии [3,4]. Однако, эти способы предполагают использование сложных
технологий и дорогостоящего оборудования, а полученные покрытия (плёнки) могут
иметь недостаточную адгезию к поверхности имплантата, недостаточную толщину,
неоднородность морфологии и кристалличности. Отдельную проблему представляет
возможность нанесения покрытий на медицинские изделия сложной формы и стабильность покрытий при стерилизации [1,9].
Альтернативным путём уменьшения негативных
последствий взаимодействия имплантатов с биологическими средами является
создание «барьера», представленного материалом органического происхождения, в
зонах контакта металлического фиксатора с тканями организма. В этих целях нам представляется возможным и
целесообразным использование фибрин-коллагенового покрытия TachoComb®, которое достаточно
широко используется при хирургических вмешательствах с целью достижения
гемостаза и аэростаза [2,13,14,15,16].
Предлагаемым способ профилактики
постимплантационных осложнений основан на изоляции имплантата от биологических
тканей путём интраоперационного покрытия области перелома и поверхности пластины
фибрин-коллагеновым комплексом ТахоКомб®.
Цель исследования – обоснование
эффективности применения фибрин-коллагеновых покрытий при накостном
остеосинтезе переломов трубчатых костей.
Материалы
и методы исследования.
Технология применения фибрин-коллагеновых
покрытий предполагает их тщательную адаптацию и прижатие к ландшафту
поверхности костной ткани в зоне перелома и поверхности имплантата для
остеосинтеза. Это является необходимым условием для достижения адгезии фрагментов
покрытия к костной ткани и имплантату, которая наступает после полимеризации
фибрина. Нами разработано и изготовлено устройство, позволяющего
максимально точно адаптировать, прижать и в течение непродолжительного
временного интервала удерживать фрагменты покрытия на поверхности кости и
имплантата для остеосинтеза (Рис.1).
|
|
Рис. 1. Устройство для аппликации
фибрин-коллагенового покрытия.
Технология нанесения
покрытия
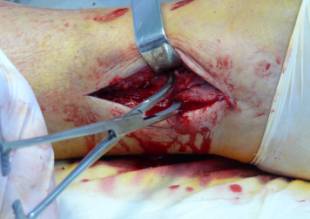
После обнажения места перелома и репозиции
костных фрагментов (Рис 2а), на кость, в предполагаемой зоне инсталляции
металлического фиксатора, накладывается пластина ТахоКомб®, жёлтая поверхность
(клеевая основа) ТахоКомб® обращена к линии перелома (Рис.2б).
Пластина ТахоКомб® моделируется к
ландшафту поверхности кости и прижимается к ней с помощью адаптирующей лопатки
(Рис.2в).
|
а |
б |
||||
|
в |
|||||
Рис.2 (а,б.в). Репозиция перелома и
нанесение фибрин-коллагенового покрытия
на костную ткань.
Металлическая пластина укладывается на покрытый
ТахоКомб® участок кости и фиксируется к кости винтами (Рис.3а). На поверхность
металлической пластины, обращённой в просвет операционной раны, накладывается
пластина ТахоКомб® (жёлтая поверхность ТахоКомб® обращена к фиксатору).
ТахоКомб® моделируется к ландшафту поверхности фиксатора и прижимается к нему с
помощью адаптирующей лопатки (Рис.3б). Поверхность пластины для остеосинтеза
полностью покрывается ТахоКомб®. Металл в области операционной раны не
визуализируется (Рис.3в).
|
а |
б |
||||
|
в |
|||||
Рис.3(а, б, в).
Остеосинтез перелома металлической пластиной, нанесение фибрин-коллагенового
покрытия на поверхность пластины
Данная методика нашла применение при лечении 35
больных с переломами костей предплечья (12) и голеностопного сустава (23),
которые составили основную группу. Группа сравнения (42 наблюдения)
представлена больными, пролеченными традиционными методиками накостного
остеосинтеза. Все имплантаты, использованные для накостного остеосинтеза,
выполнены из сплава титана и соответствовали современным международным
стандартам материалов (ISO).
Критерии оценки
эффективности применения фибрин-коллагенового покрытия
С целью объективной оценки клинических
результатов применения предлагаемой методики, в раннем послеоперационном
периоде осуществлялась оценка выраженности и динамики регресса
микроциркуляторных нарушений в области оперированного сегмента конечности,
анализ воспалительных и инфекционных осложнений операционной раны. Для оценки
степени уменьшения отёка рассчитывали интегральную количественную
характеристику отёка конечности с вычислением динамического показателя отёка по
формуле:
![]() ,
,
где
Со – исходная длина окружности; Сх – длина окружности в
момент х.
Измерение длин окружности сегмента конечности
осуществлялось на трёх уровнях.
В отдалённом периоде травмы (через 6-10
месяцев), по мере консолидации переломов осуществляли удаление
металлоконструкций. Во время операции осуществлялась визуальная оценка и
гистологическое исследование тканей периимплантатной области. Удалённые
имплантаты подвергались изучению.
Исследовали следующие параметры:
-
массу имплантатов (135.510 – 08) определяли на аналитических весах АВ-104F
ACT «Mettler Toledo»;
-
линейные размеры пластин (длина, ширина и толщина пластины в области средней
части и концевых отделов);
-
состояние поверхности пластин изучали при помощи стереоскопического микроскопа Stemi-2000C «Carl
Zeiss» с цифровой камерой Simagis;
-
с целью определения высоты микронеровностей на поверхностях имплантатов, из
пластин были изготовлены микрошлифы в поперечном сечении, которые исследовались
на металловедческом инвертированном микроскопе Axiovert-40MAT
«Carl Zeiss» с применением
специального программного обеспечения для проведения линейных измерений на
изображении (анализатор изображений - программный комплекс SIAMS-700).
Проведён статистический анализ результатов исследования.
Результаты исследования и их обсуждение.
При
анализе темпов купирования микроциркуляторных нарушений в мягких тканях
повреждённой конечности установлено, что в основной группе регресс отёка
парартикулярных тканей начинался с 3 суток с момента операции (величина ДПО
снижалась на 7,5±0,8%), а пик снижения ДПО (13,9±1,4 %) отмечен на 5 сутки. У
больных группы сравнения выявлен достоверно (Р˂0,05) более медленный темп
регресса микроциркуляторных нарушений, что свидетельствует об большей
активности воспалительного процесса в области операционной раны. Так тенденция
к уменьшению отёка отмечена на 5 сутки (5,3±0,5%), а максимальный уровень
снижения значений ДПО отмечен на 7 сутки (9,7±0,8 %).
Сведения о локальных осложнениях, развившихся в
раннем послеоперационном периоде в представлены в таблице1. Из таблицы следует,
что в основной группе больных отсутствовал такой вид осложнений как «гематома
операционной раны», что связано с гемостатическим действием ТахоКомб®. Так же
отсутствовали такие виды осложнений как глубокое нагноение и некроз мягких
тканей, что причинное обусловлено более быстрыми темпами регресса расстройств
регионарного кровообращения и улучшением процессов микроциркуляции.
Отдельного внимания заслуживает развитие поздних
осложнений воспалительного характера, которые являются следствием аллергической
реакции на металл и протекают в виде реакций гиперчувствительности замедленного
типа с преобладанием местных проявлений отторжения металлоконструкции [7,8]. В
группе сравнения развитие данного вида осложнений отмечено в 14,3 % случаев.
При комбинированном применении металлоконструкций и фибрин-коллагенового
покрытия (основная группа) развитие реакции отторжения имплантатов отмечено в
2,8%.
Таблица
1
Осложнения послеоперационных ран
|
Виды осложнений |
Клинические группы |
|
|
Группа сравнения |
Основная группа |
|
|
Гематомы |
5(11,9%) |
0 |
|
Поверхностные
нагноения операционной раны |
4(9,5%) |
2 (5,7%) |
|
Поверхностный краевой
некроз мягких тканей операционной раны |
3(7,1%) |
0 |
|
Глубокие нагноения
операционной раны |
3(7,1%) |
1 (2,8%) |
|
Поздние осложнения
области послеоперационного рубца (нагноение, отторжение имплантатов) |
6(14,3%) |
1 (2,8%) |
При
сравнительной визуальной интраоперационной оценки тканей периимплантатной
области установлено, что в группе сравнения обнаруживались участки чёрного
цвета, а также изолированные тёмные вкрапления, располагающиеся в толще
рубцовых тканей (Рис.4). Ткани, окружающие имплантат имели повышенную
плотность.

Рис.4 Пигментированные участки рубцовых тканей
периимплантатной области.
В местах введения винтов определялась выраженная
резорбция костной ткани (Рис.5)

Рис.5 Резорбция ткани малоберцовой кости в места
введения винтов.
В основной группе ткани, окружающие имплантат
имели меньшую плотность. Макроскопически отсутствовали участки пигментация
тканей, в следствии скопления частиц металла (Рис. 6 а,б).
 а
а
 б
б
Рис. 6 а,б. Отсутствие пигментации тканей периимплантатной области.
Сравнительный анализ
гистограмм показал, что в группе сравнения, имело место неравномерное накопление
металлизированных частиц, находящихся плотной соединительной ткани, содержащей
гиалинизированные грубые участки, без признаков формирования новообразованных
тонкостенных сосудов, тонких коллагеновых волокон.

Рис.7 Массивные отложения металлизированных
частиц в гиалинизированной бесклеточной фиброзной ткани.
При комбинированном
применении накостных фиксаторов с фибрин-коллагеновым покрытием (основная
группа) накопления металлизированных частиц в тканях периимплантатной области
не отмечалось (Рис.8).

Рис.8 Отложения
металлических частиц отсутствуют.
Наблюдалось
формирование рыхлой соединительной ткани, богатой новообразованными
тонкостенными мелкими сосудами капиллярного и артериального типов, тонкими
коллагеновыми волокнами. Наряду с этим встречались участки плотной соединительной
ткани, окруженные нежными «муфтами» из тонких коллагеновых волокон, без
признаков накопления гиалинового белка.
Таким образом, можно считать, что применение
Тахокомба, имеющего в своем составе коллаген (гидроксипролин) оказывает
благоприятное воздействие на процессы репаративной регенерации, способствует
развитию рыхлой соединительной ткани, формированию новообразованных
тонкостенных сосудов капиллярного и артериального типов. Данные морфологические признаки также
свидетельствуют в пользу того, что первичная воспалительная реакция на
ксеноматериал (имплантат) была минимальной.
Сравнительные
данные о параметрах геометрии и морфологии поверхности фиксаторов для
накостного остеосинтеза представлена в таблице 2.
Из таблицы следует, что высота микронеровностей
на поверхности пластинах, защищённых фибрин-коллагеновым покрытием были
достоверно ниже (Р ≤0,05) по отношению к таковым в группе сравнения, как
в зоне контакта имплантата с костной тканью (внутренняя поверхность пластины),
так и в области соприкосновении с мягкоткаными образованиями (наружная
поверхность пластины).Толщина металла и вес пластин основной группы были
достоверно больше (Р ≤ 0,05) таковых параметров по отношению к группе
сравнения. Это свидетельствует о том, что имплантаты основной группы в процессе
длительного нахождения в организме подверглись износу в меньшей степени.
Таблица
2
Параметры геометрии и морфологии поверхности пластин
|
Параметры имплантатов |
Новые (не
использованные в целях остеосинтеза) пластины |
Использованные
пластины без применения ТахоКомб® а (группа
сравнения) |
Использованные
пластины с применением ТахоКомб® а (основная
группа) |
|
Вес пластины (135.510-08) |
6,42 ± 0,22 г |
5,76 ± 0,18 г |
6,21 ± 0,09 г |
|
Высота
микронеровностей поверхностей пластины: а-наружная поверхность; б -внутренняя
поверхность. |
а)1,76 ± 0,10 мкм |
а)2,34 ± 0,16 мкм |
а)1,94 ± 0,05 мкм |
|
б)1,91 ± 0,11 мкм |
б)2,73 ± 0,11 мкм |
б)2,13 ± 0,04 мкм |
|
|
Толщина пластины: а-концевые отделы; б-средние отделы. |
а)1,45 ± 0,05 мм |
а)1,31 ± 0,03 мм |
а)1,40 ± 0,02 мм |
|
б)1,45 ± 0,05 мм |
б)1,20 ±0,03 мм |
б)1,34 ± 0,03 мм |
Меньшая степень износа имплантатов, покрытых
ТахоКомб®, является результатом привентивного действия препарата по отношению к
агрессивному воздействию биологических сред организма.
ВЫВОДЫ
Комбинированное применение фибрин-коллагеновго покрытия с
металлоконструкциям для остеосинтеза приводит к уменьшению реакции
биологических тканей на имплантаты. Это проявляется снижением активности
локального воспалительного процесса, более быстрыми темпами регресса
микроциркуляторных расстройств в области повреждённого сегмента конечности.
Применение
фибрин-коллагенового покрытия ТахоКомб с целью фармакологической защиты
имплантатов от агрессивного воздействия биологических сред, приводит к
уменьшению количества осложнений воспалительного и
дегенеративно-дистрофического характера.
ЛИТЕРАТУРА.
1. Гнеденков С.В.
Формирование и свойства биоактивных покрытий на титане / С. В. Гнеденков, Ю. П.
Шаркеев, С. Л. Синебрюхов, О. А. Хрисанфова, Е. В. Легостаева, А. Г. Завидная,
А. В. Пузь, И. А. Хлусов // Перспективные материалы. - 2011.- №2.- С.49-59.
2. Горский В.А., Зарянин
А.М., Агапов И.А. Эффективность использования ТахоКомб® в гепатобилиарной
хирургии // Клиническая медицина. - 2011.- №2.- С.61-68.
3. Калита В.И. Физика и
химия формирования биоинертных и биоактивных поверхностей на имплантатах. Обзор
/ В.И. Калита // Физика и химия обработки материалов. -2000. - №5. - С. 28-45.
4. Калита В.И., Маланин
Д.А., Мамаева В.А., Мамаев А.И., Комлев Д.А.,Деревянко И.В., Новочадов В.В.,
Ланцов Ю.А., Сучилин И.А. Модификация поверхностей внутрикостных имплантатов:
современные исследования и нанотехнологии // Вестник ВолГМУ.-2009.- №4 (32)- С.
17-22.
5. Карлов А.В.
Остеоиндуктивные, остеокондуктивные и электрохимические свойства
кальций-фосфатных покрытий на титановых имплантантах и влияние их на
минеральный обмен при переломах трубчатых костей в эксперименте / Карлов А.В. и
др. // Гений ортопедии. -1999.-№ 4. - С. 28-33.
6. Карлов А.В., Хлусов И.А.
Зависимость процессов репаративного остеогенеза от поверхностных свойств
имплантатов для остеосинтеза // Гений ортопедии. - 2003.-№3.- С.46–51.
7. Пахалюк В.И., Калинин
С.И., Олиниченко Г.Д. Биологические реакции на частицы износа, образующиеся в
традиционных и альтернативных парах трения при тотальном замещении
тазобедренного сустава // Ортопед. травматол. - 2003. - № 4. - С. 162-171.
8. Сампиев М.Т.,Лака А.А.,
Загородний Н.В.,Дубов А.Б., Балашов С.П., Он Т.Е. Анализ поздних воспалительных осложнений при лечении
деформаций позвоночника с использованием двухпластинчатых эндокорректоров с
полисегментарной фиксацией // Хирургия позвоночника.- 2007.-№ 3.- С. 20–25.
9. Филлипенко В.А. Роль
материалов и биоимплантационных покрытий в развитии проблем эндопротезирования
/ В.А. Филлипенко, Л.А. Кладченко, И.Б. Тимченко // Ортопед, травматол. - 1998.
- № 3. - С. 47–52.
10. Шехтер А.Б., Розанова
И.Б. Тканевая реакция на имплантат / В кн: «Биосовместимость» / под ред.
В.И.Севастьянова. М. 1999. С. 174-208.
11. Шехтер А.Б., Серов В.В.
Воспаление и регенерация. В кн. Воспаление.М. Медицина, 1995, С.200-219.
12. Шубкин Р.Р., Татиатулин
Р.Р., Горчаковский В.К., Первышина Е.П. Коррозия имплантатов из титановых
сплавов как результат воздействия окружающей среды // Анналы травматол. и
ортопед. -1996. - № 2 - С. 43–44.
13. Lang G, Csekeo A, Stamatis G, Lampl L, Hagman L, Marta GM, Mueller MR,
Klepetko W. Efficacy and safety of topical application of human
fibrinogen/thrombin-coated collagen patch (TachoComb) for treatment of air
leakage after standard lobectomy// Eur J Cardiothorac Surg.- 2004.-№ 25.- Р 160-166.
14. Nistor R.F., Chiari F.M., Maier H., Hehl K. The fixed combination of
collagen with components of fibrin adhesive - a new hemostypic agent in skull
base procedures.//Scull Base Surgery.- 1997.-№ 7(1).-Р 23-30.
15. Parker S.J., Brown D., Hill P.F., Watkins P.E. Fibrinogen-impregnated collagen combined haemostatic agent and
antibiotic delivery systemin a porcine model of splenic trauma// Eur J Surg.-
1999.-№ 165.-Р 609-614.
16. Scheyer M., Zimmermann G. Tachocomb used in endoscopic surgery // Surg
Endosc.- 1996.-№ 10(5).-Р 501-503.
17. Schmutz P. Metallic medical implants: electrochemical characterization
of corrosion processes // The Electrochemical Society. – 2008.- P.35-40.