ЦЕЛЕСООБРАЗНОСТЬ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ
У НАРКОЗАВИСИМЫХ ПАЦИЕНТОВ
Бычков Е.Н., Бычков А.Е.
ГБОУ ВПО
«Саратовский Государственный Медицинский Университет им.
В.И.
Разумовского» Минздрава РФ, Саратов,
Россия
Резюме
Изучение
молекулярно-генетических маркеров у наркозависимых пациентов позволит
приблизиться к пониманию патологических механизмов, лежащих в основе этого
заболевания и создать «генетический паспорт» для каждого пациента, страдающего
данным заболевнаием. В статье представлено изучение генетических маркеров 5,10-метилентетра-гидрофолатредуктазы,
участвующей в метаболизме гомоцистеина и N-ацетилтрансферазы,
обеспечивающей процесс превращения ацетил-коэнзима А в ацетоацетил-коэнзим А, а
также генов, участвующих в детоксикации наркотических препаратов. Обнаружены
закономерности распределения полиморфных вариантов генов, кодирующих ферменты,
участвующие в указанных энзиматических процессах в группе больных наркоманией,
что является прологом в исследовании данного патологического процесса.
Ключевые слова: наркомания, метаболические процессы, генетические
маркеры.
Введение
Фармакогенетика - наука о генетически
обусловленной индивидуальной реакции организма на лекарство. Ее концептуальные
положения базируются на принципах генетического разнообразия человека,
связанных с наличием генетического полиморфизма. В зависимости от
индивидуальных особенностей генома различные индивиды могут сохранять
устойчивость или обнаруживать повышенную чувствительность к повреждающим
агентам и лекарственным препаратам [1]. Большинство ксенобиотиков, попадая в
организм, не оказывают прямого биологического эффекта и подвергаются
биотрансформации - серии метаболических реакций, после чего выводятся из
организма [2, 3, 4].
Реакции биотрансформации контролируются специальными ферментами системы
детоксикации. Наследственные изменения активности таких ферментов и/или
несбалансированность в их работе, обусловленные генетическим полиморфизмом,
приводят к неадекватной реакции организма на различные ксенобиотики. Следствием
этого могут быть нежелательные побочные реакции либо отсутствие
терапевтического эффекта при приеме лекарственных средств. Наличие точных
данных о химической структуре лекарства, биомеханизме его действия, а также о
ферментных системах, контролирующих этот процесс, дополненных сведениями о
строении соответствующих генов, способствует прогрессу фармакогенетики как
одному из наиболее перспективных разделов молекулярной медицины. Более того,
выявление ассоциаций полиморфных вариантов генов с различной индивидуальной
чувствительностью к лекарственным препаратам позволяет не только уточнить
патогенез самого заболевания, но и разработать оптимальную стратегию лечения с
учетом биохимической индивидуальности пациента
[4, 5, 6, 1].
Началом любой клинической симптоматики
выступают изменения на молекулярном уровне, которые предшествуют развитию
полноценной картины заболевания. Выявление подобных молекулярных маркеров
представляет собой отдельную задачу и зависит от конечной цели исследования.
Можно говорить о своеобразном «дизайне» или «скелете» проводимых исследований
для получения информации о прогрессировании заболевания и ранней диагностики
начальных форм патологии.
Особо следует отметить значение
молекулярно-генетических исследований, поскольку многие процессы в организме
детерминированы генетически и для успешного симптоматического лечения наркозависимых
пациентов в обязательном порядке необходимо учитывать также и роль молекулярно-генетического фактора, поскольку
биохимические показатели могут отражать метаболические процессы, протекающие в
организме наркоманов и определяемые генетическим фактором [1, 9]. К такого рода
процессам можно отнести детоксикацию наркотических препаратов, их проникновение
в ткани головного мозга, процессы выведения наркотиков из организма и многие
другие [7, 8, 9].
Материалы и методы
Исследование проводилось в течение пяти
лет: с 2007 по 2011 гг. В исследование были включены 250 больных, страдавших
хронической опийной наркоманией, которая привела к развитию различной
выраженности печеночной и почечной патологии и артериальной гипертензии.
Всем пациентам проводилось
стандартное клинико-инструментальное обследование и молекулярно-генетические исследования с использованием биочипов.
Таблица 1. Общее число
обследованных наркозависимых пациентов.
|
Пол |
Возраст |
|||||
|
18-29 лет |
30-49 лет |
50-60 лет |
||||
|
абс. |
% |
абс. |
% |
абс. |
% |
|
|
Мужчины |
102 |
40,8 |
63 |
25,2 |
39 |
15,6 |
|
Женщины |
23 |
9,2 |
12 |
4,8 |
11 |
4,4 |
|
Итого (n=250) |
125 |
50 |
75 |
30 |
50 |
20 |
Таблица
2. Общее число пациентов с различным стажем употребления наркотиков.
|
Пол |
Стаж употребления наркотиков |
|||||||
|
2-3 лет |
4-5 лет |
6-8 лет |
более 9 лет |
|||||
|
абс. |
% |
абс. |
% |
абс. |
% |
абс |
% |
|
|
Мужчины |
32 |
12,8 |
70 |
28 |
63 |
25,2 |
39 |
15,6 |
|
Женщины |
18 |
7,2 |
5 |
2 |
12 |
4,8 |
11 |
4,4 |
|
Итого (n=250) |
50 |
20 |
75 |
30 |
75 |
30 |
50 |
20 |
Биочипы
– массивы ячеек, содержащих различные молекулярные зонды. Биочипы изготавливаются
методом фотоиндуцируемой совместной полимеризации олигонуклеотидов и
компонентов акриламидного геля. Гелевые ячейки микрочипа полусферической формы
химически пришиты к твердой поверхности, в каждой ячейке иммобилизированы
молекулы зонда одного типа. Зонды нанесены на поверхность микрочипа в
определенной последовательности, размер ячеек составляет 150 мкм. Проведение
полимеразной цепной реакции (ПЦР) осуществлялось в два этапа с добавлением
праймеров, специфичных к исследуемым генам. Флуоресцентное мечение ПЦР-продукта
проводили на втором этапе ПЦР с помощью красителя пентаметинового ряда. При
этом праймер, содержащий флуоресцентную метку, добавляли в ПЦР-смесь в более
высокой концентрации, чем немеченый праймер, таким образом, чтобы
преимущественно нарабатывалась одна меченая цепь. В процессе дальнейшей
гибридизации на биочипе происходило специфическое взаимодействие молекул-зондов
и молекулы-мишени по принципу комплементарности. Гибридизационную смесь
полностью денатурировали в течение 5 минут при 95°С, охлаждали во льду,
наносили на биочип и инкубировали в течение 10-12 часов при 37°С. После
завершения инкубации и удаления гибридизационной смеси поверхность биочипа
высушивалась сжатым воздухом, проводилась регистрация флуоресцентных сигналов с
помощью портативного анализатора, снабженного программным обеспечением Imagewer
(Институт молекулярной биологии им. В.А Энгельгардта РАН, Россия). Картина
гибридизации представляет собой распределение сигналов флуоресценции, наиболее ярких в точках специфического
связывания зонда и мишени. Метод использования ДНК-чипов высокоинформативен,
позволяет анализировать до 50 полиморфных вариантов генов с точностью более
99%.
Результаты и
обсуждение
Исследование
полиморфизма генов MTHFR и NAT2.
Рассмотрим полиморфизмы генов, которые
исследовались в данном фрагменте работы и дадим оценку превращениям
наркотических препаратов, которые, скорее всего, происходят в клетках печени
при участии продуктов исследованных генов. Продукт гена MTHFR осуществляет обратное превращение морфина в кодеин вследствие процесса
метилирования морфина:
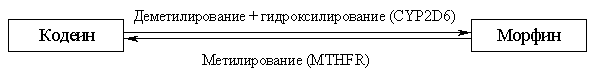

Концентрация кодеина и морфина в сочетании
с активностью гена MTHFR определяют превращение
наркотиков друг в друга и степень наркотического эффекта у различных категорий зависимых
от героина пациентов. При активном цитохроме CYP2D6 и неактивном продукте гена MTHFR происходит образование больших количеств морфина и
наркотический эффект будет достигаться при меньших концентрациях кодеина и
морфина. В том случае, если активность цитохрома CYP2D6 снижена, а активность гена MTHFR повышена, - будет
происходить обратная реакция: более интенсивно пойдет процесс превращения
морфина в кодеин и наркотический эффект будет снижен.
Подобная ситуация заставит наркозависимого
пациента, с одной стороны, использовать повышенные концентрации кодеина или
морфина, а с другой стороны, будет способствовать применению таких препаратов
как фенобарбитал, которые стимулируют образование белков-цитохромов, в
частности, цитохрома CYP2D6.
Превращение героина в морфин проходит
поэтапно. На первом этапе образуется 6-моноацетилморфин (6-МАМ) за счет
деацетилирования одного остатка уксусной кислоты от героина и на втором этапе
образуется морфин вследствие деацетилирования второго остатка уксусной кислоты
от 6-МАМ. На обоих этапах участвуют два типа ферментов: ацетил-гидролазы и
ацетил-трансферазы. Возможно протекание и обратного процесса с участием
активной формы уксусной кислоты - ацетил-КоА - и фермента ацетил-трансферазы.
Данный фермент переносит активированный остаток уксусной кислоты на морфин с
образованием 6-МАМ. Подобная ситуация возможна в двух случаях: при наличии
достаточных количеств ацетил-КоА и при активной форме ацетил-трансферазы,
которая определяется полиморфизмом гена NAT2.


Концентрация ацетил-КоА может быть
увеличена при активной работе пируватдегидрогеназного комплекса и сниженной
активности цикла Кребса, одной из причин развития которой может быть гипоксия.
В нашем исследовании обнаружены следующие
распределения полиморфизма генов NAT2 и MTHFR: NAT2– 70% (Т/Т
полиморфизм, то есть «дикий» тип составил 30%, гетерозиготы Т/С составили 68% и
гомозиготы С/С были представлены 2% от всего количества исследованных
образцов), NAT2*S1– 70% (С/С полиморфизм, то есть «дикий» тип составил
30%,
гетерозиготы С/Т составили 68% и гомозиготы Т/Т были представлены 2% от всего
количества исследованных образцов), NAT2*S2– 65% (G/G, полиморфизм, то есть «дикий» тип составил 35%, гетерозиготы G/А
составили 58% и гомозиготы А/А были представлены 7% от всего количества
исследованных образцов ), NAT2*S3– 0-1% ( полиморфизм этого гена был представлен в
основном «диким» типом - G/G).
Выявлен полиморфизм гена MTHFR, отвечающего за
превращение морфина в кодеин и за образование гомоцистеина: MTHFR – 40% (С/С полиморфизм, то есть «дикий» тип составил 60%, гетерозиготы С/Т
составили 30% и гомозиготы по рецессиву - Т/Т - были представлены 10% от всего
количества исследованных образцов).
Исследование
полиморфизма гена MDR1.
Изучен
полиморфизм гена MDR1, ответственного за
синтез гликопротеида Р, который, в свою очередь, встроен в мембрану клеток гематоэнцефалического барьера и клеток
энтероцитов и «отвечает» за проникновение гидрофобных и дифильных молекул через
гематоэнцефалический барьер, а также через мембрану клеток кишечного эпителия.
В
исследовании полиморфизм данного гена составил 80% (С/С полиморфизм, то есть
«дикий» тип составил 20%, гетерозиготы С/Т составили 55% и гомозиготы Т/Т были
представлены 25% от всего количества исследованных образцов),
Полиморфизмы
С/Т и Т/Т указывают на ослабление функции данного гена. Следовательно, только
20% наркозависимых пациентов, имеющих «дикий» тип полиморфизма могут попасть в
группу риска, так как именно у них функция данного гена, скорее всего, не
нарушена и гликопротеин Р, встроенный в мембрану клеток гематоэнцефалического
барьера будет эффективно «выбрасывать» 6-МАМ или морфин за пределы
гематоэнцефалического барьера и, следовательно, за пределы головного мозга.
Это, в свою очередь, заставит зависимого пациента увеличивать дозировку
наркотического препарата, что в свою очередь может привести к летальному исходу
из-за развивающейся гипоксии тканей и мозга вследствие угнетения морфином
клеток дыхательного центра головного мозга. Кроме того, морфин способен
накапливаться в эритроцитах, провоцируя развитие транспортной гипоксии.
Наркозависимых
пациентов с полиморфизмом гена MDR1 по «дикому» типу
можно отнести к группе риска по развитию гипоксических состояний и,
следовательно, в проводимой терапии необходимо учитывать гипоксический статус
пациента и направлять лечение на коррекцию гипоксического состояния у данной
группы пациентов.
Исследование
полиморфизма генов цитохрома Р450
Обнаружен полиморфизм в генах системы детоксикации у героиновых наркоманов:
СУР2С9*2
- 20 % (С/С полиморфизм, то есть «дикий» тип
составил 80%, гетерозиготы С/Т составили 20% и гомозиготы Т/Т были представлены 0-1%
от всего количества исследованных образцов),
СУР2С9*3
- 20 % (А/А полиморфизм, то
есть «дикий» тип составил 80%, гетерозиготы А/С составили 20% и гомозиготы С/С были
представлены 0-1% от всего количества исследованных образцов),
CYP2D6*4 - 30 % (G/G полиморфизм, то
есть «дикий» тип составил 70%, гетерозиготы G/А составили 15% и
гомозиготы А/А были представлены 15% от всего количества исследованных
образцов),
CYP2D6*3 - 0-1 % (отсутствие делеции в гене как полиморфизм, то есть «дикий» тип составил
98%,
гетерозиготы с делецией гена составили 0-1% и гомозиготы с делециями в гене по
материнской и отцовской хромосомам были
представлены 0-1% от всего количества исследованных образцов),
CYP2C19 - 25 % (G/G полиморфизм, то
есть «дикий» тип составил 75%, гетерозиготы G/A
составили 20% и гомозиготы А/А были представлены 5% от всего количества
исследованных образцов),
GSTM1 - 70 % (отсутствие делеции в гене как полиморфизм, то есть «дикий» тип составил 30%, гетерозиготы с делецией гена составили 68% и
гомозиготы с делециями в гене по материнской и отцовской хромосомам были представлены 2% от всего количества
исследованных образцов),
CYP1A1 - 35 % (wt/wt полиморфизм, то есть «дикий» тип составил 65%, гетерозиготы 2A/wt составили
25%, гетерозиготы по полиморфизму 2В/wt составили 5% и гомозиготы 2В/2В были
представлены 5% от всего количества исследованных образцов).
Заключение
У наркозависимых пациентов прослеживается
взаимосвязь между печеночной и почечной паренхимой из-за утилизации наркотиков
в печени с последующим их выведением через почки, поэтому состояние генов
детоксикации в гепатоцитах, таких как, цитохром – CYP-2D6 является одним из индикаторов, указывающих на
процессы инактивации наркотических препаратов и их эффективность.
Выявлен полиморфизм гена MTHFR, отвечающего как за
превращение морфина в кодеин, так и за метаболизм гомоцистеина.
20 %
наркозависимых пациентов составляют особую группу риска, так как «дикий» тип по
аминокислотному составу и высокая
плотность гликопротеина Р на мембранах клеток гематоэнцефалического барьера
тормозит проникновение морфина и героина в клетки головного мозга наркоманов,
что в свою очередь требует увеличения дозы опиатов для достижения
наркотического эффекта. Полиморфизм гена MDR1
по «дикому» типу способствовать развитию гипоксии.
Список
литературы
1. Голденкова-Павлова, И.В., Брускин
С.А., Абдеев Р.М. и др. Сравнительный анализ результатов фенотипирования и
генотипирования по полиморфизму N-ацетилирования у человека// Генетика: журнал
Российской академии наук. – 2006. – Т. 42. - №8. – С. 1143-1150.
2. Vatsis, K.P. Nomenclature for N-acetyltransferases / Vatsis K.P., Weber W.W., Bell D.A. // Pharmacogenetics. – 1995 - № 5 (1). – С. 1–17.
3. Сулейманов С.Ш. особенности
функционирования системы биотрансформации ксенобиотиков в адаптивных реакциях и
патологии малочисленных народов Крайнего Севера: Автореф. Дисс …. докт. мед.
наук. – 1997 . – 47с.
4. Hein, D.W.
Molecular genetics and epidemiology of the NAT1 and NAT2 acetylation
polymorphisms/ Hein D.W., Doll M.A, Fretland A J. // Cancer
Epidemiol Biomarkers Prev. - 2000. - №9 (1). – Р. 29 - 42.
5. Минушкина Л.О. Гены ангиотензинпревращающего фермента, NO-синтетазы
и эндотелина-1 и гипертрофия миокарда левого желудочка у больных
гипертонической болезнью коренных жителей Якутии// Кардиология. – 2005. – №1. – С. 41-45.
6. Oparil S, Zaman A, Calhoun DA. Pathogenesis of hypertension. Ann Intern Med 2003; 139: 761–76.
7.
Miyamoto Y, Saitio Y., Kajiyama N. et al. Endothelial nitric oxide synthase gene is
positively associated with essential hypertension // Hypertension. 1998. 32.
3–8.
8.
Cattaneo
M. Hyperhomocysteinemia, Atherosclerosis and Thrombosis. Thromb Haemost, 1999;
81: 165-176.
9. Heux S., Morin F., Lea R.A. The
methylentetrahydrofolate reductase gene variant (C677T) as a risk factor for
essential hypertension in Caucasians// Hypertens. Res. – 2004. – Vol. 27, №9. –
P.663-667.