Медицина/7. Клиническая медицина
Бунчина
Н.Ю, д.ф.-м.н. Пожар В.Э.
«МАТИ» -
РГТУ им. К.Э. Циолковского, Россия
НТЦ
уникального приборостроения РАН, Россия
Тенденции развития
диагностики онкологических заболеваний на ранней стадии методом
акустооптической фотофлюорисцентной спекроскопии.
Применение разнообразных методов диагностики
необходимо для выявления опухолевого процесса, определении его стадии и выбора
тактики лечения больных, страдающих онкологическими заболеваниями. Во многих
случаях для дифференциальной диагностики необходимо провести несколько
исследований, используя различные методы. При планировании исследования, прежде
всего, необходимо учитывать индивидуальные особенности пациента и особенности
течения заболевания, а также знать принципы, возможности и ограничения каждого
из методов. Это становится особенно актуальным, когда речь идет о диагностике
онкологических заболеваний на ранней стадии, когда размер опухоли не превышает
1-2 мм в диаметре.
В настоящее время не существует ни одного
точного метода ранней диагностики онкологических заболеваний дающего
достоверный результат. Поэтому для обеспечения достаточного уровня надежности,
диагностирования применяют комплексные методы обследований, которые включают в
себя в различных комбинациях следующие разновидности исследований:
·
Лучевая
диагностика (как правило, рентген)
·
УЗИ
·
Лабораторная
диагностика
·
Радиоизотопная
диагностика
·
Эндоскопическая
диагностика
·
Биопсия
(включая цито-гистологические методы исследований)
Тем не менее, перечисленные методы не в
состоянии дать точных результатов при размерах опухоли менее 1 мм. На данном
этапе развития заболевания можно лишь
получить косвенное подтверждение развивающегося патологического процесса на
основе анамнеза и онкомаркерной лабораторной диагностики, цель которой –
определение в исследуемой крови наличия и концентрации специфических
онкомаркеров – уникальных белков, вырабатываемых раковыми клетками. Однако этой
информации оказывается недостаточно для точной локализации патологического
процесса на данном этапе заболевания. Также следует учитывать, что на основании
одного лишь этого исследования невозможно установить диагноз, т.к. размеры
опухоли еще малы, и концентрация соответствующих онкомаркеров не будет сильно
выходить за пределы физиологической нормы, тем более, что наличие тех или иных
маркеров еще не обязательно будет сигнализировать о развитии именно
злокачественной опухоли, ведь некоторые доброкачественные и воспалительные
процессы, аутоиммунные заболевания, а также специфические состояния (например,
беременность) могут также инициировать продуцирование различных видов маркерных
белков, например: CA 72-4, CA 19-9, РЭА,
CA 125, АФП, SCC, HCE,
ХГЧ, PSA, b-2-микроглобулин и др. При этом важно исключить возможность наличия
доброкачественных воспалительных процессов и аутоиммунных заболеваний, которые
могут вызвать повышение уровня концентрации онкомаркерных белков. Только после
этого возможно судить о развитии злокачественной опухоли.
Для проведения дальнейшей точной диагностики, в
настоящее время возможно применить новейший метод фотофлюорисцентной
спектроскопии, основанный на применении эффекта люминисценции введенных в
патологическую ткань фотосенсибилизаторов при облучении подвергающегося
исследованию участка ткани монохроматическим светом соответствующей длинной
волны и регистрации спектра излучения. Данный метод дает контрастное
изображение исследуемого участка ткани высокого разрешения при условии правильного
подбора фотосенсибилизатора, его концентрации, длины волны возбуждающего
излучения и метода обработки полученных спектральных данных. В разработанном
нами методе в качестве диагностических препаратов применяются субстанции на
основе платинового комплекса копропорфирина (Pt-CP) и иттербиевого комплекса
диметоксигематопорфирина [1]. Известно, что порфирины способны селективно
накапливаться в клетках злокачественной опухоли, однако, проведение раннего
люминисцентного распознавания появляющихся опухолей с применением веществ этого
типа ограничено, благодаря маскирующему эффекту красной фоновой люминесценции,
вызванной присутствием в биотканях эндогенных порфиринов (в том числе и
копропорфирина). Включение в молекулу копропорфирина иона платины смещает максимум
люминисценции в диапазон 600-750 нм, благодаря этому маскирующий эффект резко
минимизируется, а разрешение получаемого изображения увеличивается. Кроме того,
платиновый комплекс копропорфирина обладает более высокой селективностью к
злокачественной ткани, более высоким квантовым выходом люминесценции при
воздействии лазерного облучения, широкой доступностью копропорфирина,
получаемого микробиологическим путем, низкой токсичностью, стабильностью,
хорошей растворяемостью в водных растворах и устойчивостью во всем диапазоне pH
(в то время, как иттербиевые комплексы известных порфиринов стабильны при pH
выше 6, что ограничивает их применение в диагностических исследованиях). Регистрирующая аппаратура (онкофлуориметр [2])
сконструирован на базе акустооптического спектрометра работает следующим
образом. Излучение возбуждающего источника (лазера) по волоконно-оптическому
зонду доставляется до исследуемого объекта. Рассеянное объектом излучение
отфильтровывается режекторным фильтром, отсекающим длину волны возбуждения, и
фокусируется на входном торце волоконно-оптического зонда, передающего
изображение. Зонд доставляет излучение на акустооптический спектрометр,
который перестраивается по спектру в
определенные моменты времени, после чего изображение фиксируется ПЗС матрицей
видеокамеры. Полученная серия спектральных изображений 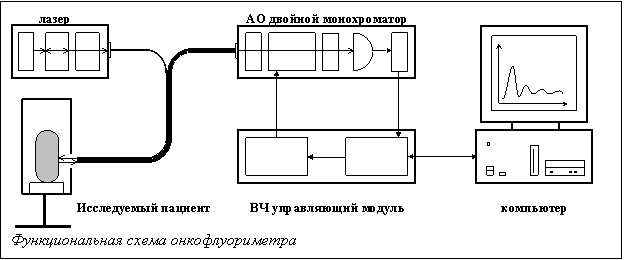 обрабатывается специальным программным обеспечением [3].
обрабатывается специальным программным обеспечением [3].
В состав предлагаемого онкофлуориметра входят
следующие модули:
·
Акустооптический
монохроматор (АОМ)
·
Управляющий
модуль (синтезатор и усилитель ВЧ сигнала)
·
Фотоприемный
модуль
·
Блок
АЦП
·
Блок
питания
·
Дополнительный
подвижный фильтр (может встраиваться в тракт или выводиться)
·
Оптоволоконный
Y-образный зонд (соединяет лазер и монохроматор с объектом измерения)
·
Лазер
Данная аппаратура обладает
достаточно высокой чувствительностью и высоким пространственным разрешением и
позволяет с высокой точностью определять местоположение пораженных участков
биотканей и их границы.
Для обеспечения автоматизации обработки данных,
полученных с АО спектрометров, сам процесс обработки информации (решение
поставленной задачи) представляется с помощью сценария обработки данных[4]. В
данном случае под сценарием понимается упорядоченный набор операций обработки 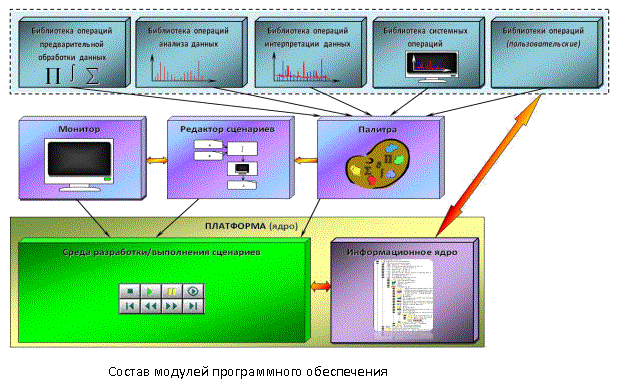 спектральных данных, представляющих собой спектры и
спектральные характеристики.
спектральных данных, представляющих собой спектры и
спектральные характеристики.
Основу программного
обеспечения составляет платформа (ядро), которое включает в себя два
компонента:
·
среду
разработки/выполнения сценариев –
набор программных средств, предназначенных для создания, а также выполнения,
сохранения (в отдельную библиотеку) и загрузки сценариев обработки спектральных
данных,
·
информационное ядро
(ИЯ), которое выполняет функцию
организации рабочих данных на всех этапах решения поставленных задач, включая
работу с библиотекой сценариев.
Объединение указанных двух
компонентов платформы (ядра) обеспечивает реализацию двухуровневой интеграции:
интеграции на уровне операций и интеграции на уровне данных (информации).
Сами операции
обработки/анализа спектральных данных реализуются в виде интерактивных
операторов графического языка сценариев. Вся совокупность операций группируется
по типам решаемых задач в библиотеки операций.
Помимо этого, реализован
механизм разработки/добавления подобных библиотек операций с целью реализации возможности расширения
функциональности системы и адаптации ее под конкретные задачи (выполнение
требований адаптируемости, модернизации, масштабируемости системы).
Отдельно следует упомянуть о
реализации средств визуализации, инструментов для работы с данными,
инструментов организации связей (потоков данных) между элементами сценариев
(операторами). Операции этой группы
размещены в отдельной библиотеке – библиотеке системных операций.
Все библиотеки операций
взаимодействуют как с информационным ядром, так и со средой
разработки/выполнения сценариев.
Кроме того, реализован
механизм связи данного программного обеспечения с системой управления АОС, что
позволяет корректировать параметры последующих измерений.
Применение описанного
программного обеспечения позволяет оперативно решать поставленные задачи,
достигается высокая степень автоматизации и точности процесса интерпретации
полученной информации, что значительно расширяет возможности, и повышает
точность диагностики заболеваний на ранних стадиях.
Литература:
1.
В.Э.Пожар,
В.И.Пустовойт, И.Б.Кутуза, А.В.Перчик. Перспективы использования
акустооптического видеоспектрометра для задач фотолюминесцентной диагностики.
Альманах клинической медицины, т.XII, М.:2006, с.28.
2.
В.Э. Пожар, А.В. Перчик,
В.Н. Шорин, С.В. Боритко, И.Б. Кутуза. Спектрометрический стенд на основе
акустооптических монохроматоров для задач фотолюминесцентной спектроскопии.
Труды 2-й Межд. конференции “Акустооптические и радиолокационные методы
измерений и обработки информации” (Суздаль, 25-27 сентября 2007), с. 112-116.
3.
Бунчина Н.Ю., Липатов
А.И. «Аспекты интеграции информационных систем проектирования электронных
систем» - Сб. трудов Всероссийской
научнотехнической конференции «Новые материалы и технологи НМТ-2008», том 3. –
М., МАТИ-РГТУ им. К.Э. Циолковского, 2008 г., XX c.
4.
Н. Бунчина, В. Пожар
«Интерпретация спектров при диагностике заболеваний» - Научно-технический
журнал «Фотоника» №6/2009, М., «Техносфера», 2009 г.