УДК 579:
616.992.282: 57. 063.8+615.322+547.963.61.001.6
В.М. Лахтин, А.Л. Байракова, М.В. Лахтин, А.В. Алешкин,
С.С. Афанасьев, В.А. Алешкин
Биопленки смешанных микробиоценозов урогенитального биотопа
человека: концепция спаренных антагонистических компартментов,
прогностико-диагностические паттерны
Московский НИИ
эпидемиологии и микробиологии им. Г.Н. Габричевского
Резюме
На примере кандид и
лактобацилл урогенитального биотопа человека предложены подходы к мониторингу раннего
пленкообразования штаммами микроорганизмов и их смесями для оценки текущего
статуса биотопных микробиоценозов человека, отбору комбинированных источников для клеточной и молекулярной противобиопленочной
терапии.
Ключевые слова: дрожжи, лактобациллы, микробиоценозы, биотоп.
Resume
Lakhtin V.M., Bajrakova
A.L., Lakhtin M.V., Aleshkin A.V., Afanasiev S.S., Aleshkin V.A. Biofilms of
mixed urogenital human microbiocenoses: conception of biotope coupled antagonistic compartments, prognostic-dioagnosctic
patterns
G.N. Gabrichevsky Research Institute for Epidemiology &
Microbiology, Moscow
Proposed approaches to the monitoring early biofilm forming
by microbial strains and their mixtures can be used for evaluation of healthy
status of human biotope microbiocenoses
as well as for choice of new sources for cellular and molecular therapy
(antibiofilm, antipathogen, alternative to antibiotics, immunovodulator,
enzyme, cytokine or combinative type).
Key words: yeasts, lactobacilli, microbiocenoses, biotope, patterns.
ВВЕДЕНИЕ
Перспективы развития пробиотикотерапии
оцениваются как стратегические [2]. Индустриальные штаммы пробиотических микроорганизмов являются источником многих полезных
эффекторов [4-6]. Пробиотические бактериальные факторы (меж)клеточной адгезии препятствуют
пролонгированию резистентных к антибиотикам микробных ассоциатов и биопленок,
усиливают системную антипатогенную активность [7, 10]. Нормофлора биотопа
человека характеризуется как саморегулирующаяся система, как в случае
лактобациллярного потенциального синбиотического компартмента [9]. Скрининг
нормофлоры человека в отношении способности к образованию биопленок и их деградации является
актуальной задачей.
Цель –
разработать скрининговый
визуальный метод отбора штаммов и потенциальных консорциумов нормофлоры
человека (в том числе пробиотической направленности) для создания новых
синбиотических, симбиотических и безклеточных лекарственных форм, значимых для профилактики
и терапии внутриполостных болезней.
МАТЕРИАЛЫ И МЕТОДЫ
Дрожжи Candida (штаммы Y1,…Y8)
и лактобациллы Lactobacillus (штаммы L1,…L12)
выделены из нормофлоры урогенитального биотопа здоровых доноров (при
обследовании в клинико-диагностическом центре Института им. Г.Н. Габричевского
нарушения биотопа отсутствовали) стандартными методами, в том числе с
использованием агара Сабуро или Lactobacillus MRS
Agar (HiMedia) в анаэробных условиях
(анаэробных генбоксах (GENbox, BioVerieux,
Франция). Использовали также среду Shaedler
на агаровой основе, цветные среды для видовой идентификации кандид (HiMedia,
Индия). Были идентифицированы C. albicans (штаммы Y1-Y4), C. tropicalis (штаммы Y5, Y6 и
Y8) и C. krusei
(штамм Y7). По данным использования стандартных наборов
диск-антибиотиков (HiMedia, Индия) дрожжи
проявляли чувствительность к нистатину, амфотерицину и клотримазолу, а
лактобациллы – к таким антибиотикам гинекологического ряда как цефазолин,
цефатоксим, доксициклин, рокситромицин и ампициллин. Оптическую плотность
культур в физрастворе измеряли на денсилометре (Densi-la-Meter,
Erba Lachema, Чешская Республика). Свежеприготовленные
суспензии штаммов с оптической мутностью 1 ед. по МакФарланду добавляли раздельно или парами Y-L (в
равных соотношениях; в общем объеме 20, 40, 60, 80 или 100 мкл [в контролях вместо
партнерских микроорганизмов добавляли соответствующий объем физраствора] в 280,
260, 220 или 200 мкл стандартного бульона MRS: варианты A, B, C, D и E,
соответственно) по 150 мкл в лунки 96-луночной полистироловой микропанели (Nunc
Nunclon, Sigma, США) или стриповой
пластиковой микропанели (ООО «Биомедикал», РФ). Микропанели инкубировали 48 ч
при 37оС. Жидкость вытряхивали, лунки промывали физраствором и
дистиллированной водой и окрашивали генциан-виолетом (НИЦФ, Санкт-Петербург):
добавляли в лунки по 150 мкл красителя и микропанель инкубировали 30 мин при
комнатной температуре. После удаления избытка красителя и промывки лунок цветные биопленки культур фотографировали
фотоаппаратом Cannon (разрешение- 12.1
мегапикселей), сканировали на приборе HP Deskjet
F2187 и редактировали в системе Windows-2007. Визуально оценивали влияние рассасывающей биопленку
активности (РБА) и противоположное действие полисахаридов и других адгезинов [1,
3]. Для количественной (более
точной) оценки биопленок регистрировали поглощение фиксированных этанолом
биопленок с красителем в лунках при 620 нм. Результаты усредняли по трем и более измерениям и оценивали
достоверность различий по критерию Стьюдента.
РЕЗУЛЬТАТЫ
В случае микропанели Nunc
Nunclon биопленки лучше сорбировались и регистрировались
по сравнению с использованием других пластиковых (не полистироловых)
микропанелей с меньшей гидрофобностью дна лунок. Штаммы различались по способности к пленкообразованию,
которое зависело от соотношения микробов и среды (рис. 1). Из рис. 1 видно, что в случае дрожжей
биопленкообразование преимущественно выражено в условиях B, С и D. В случае лактобацилл для выявления межштаммовых различий удобны те же
условия, что и для дрожжей. В то же время в условиях А наблюдалось плохо
контролируемое пленкообразование лактобациллами или кандидами, а в условиях Е
наблюдалось выраженное побочное образование дисперсных надпленочных агрегатов. Для исследования влияния лактобацилл на пленкообразование дрожжей
близкими к оптимальным были условия С.
В целом, биопленки кандид
характеризовались более выраженными однородностью, непрерывностью и площадью
распространения по сравнению с таковыми лактобацилл. В составе биопленок наблюдались
полисахаридные агрегаты, неравномерно распределенные на поверхности пленки и по
ее краям в случае штаммов кандид (Y7> Y8, Y6),
а также РБА - в случае других штаммов (Y1, Y3, Y2: все
относятся к виду C. albicans).
В случае лактобацилл РБА регистрировалась у штаммов L10, L9, L3, L6 и
L5, а полисахаридные факторы – у штаммов L11,
L9, L10 и L1. В
сравнении с монокультурами имело место модулирование биопленок в смешанных
парных культурах дрожжи-лактобациллы. В смешанных парных культурах порядок
ранжирования пленкообразования менялся для каждого штамма Y (в
зависимости от особенностей 12 штаммов L), а для каждого штамма L
- в
зависимости от особенностей 8 штаммов Y (табл. 1). В таких
культурах способность образовывать пленки снижалась: а) Y7>
Y1> Y8> [Y3, Y2]>
Y6> [Y5, Y4]
(под влиянием 12 штаммов лактобацилл на отдельные штаммы дрожжей); б) L8>
L12> L11> L9>
L1> L7> L10>
[мало различающиеся штаммы в группе со слабым или отсутствующим
пленкообразованием: L6, L5, L3, L2 и
L4] (под влиянием 8 штаммов дрожжей на отдельные штаммы
лактобацилл). Наблюдалось снижение пленкообразования штаммами Y2, Y4 и
Y5 под влиянием лактобацилл (потенциального пробиотического микробиоценоза,
включающего 12 штаммов лактобацилл), а также снижение пленкообразования
штаммами L11, L7 и L10
под влиянием микробиоценоза 8 штаммов кандид из того же биотопа популяции
индивидуумов, что и лактобациллы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные демонстрируют способность исследованных
штаммов кандид и лактобацилл образовывать ранние биопленки, варьирующие
качественно и количественно. Наличие гидролитического потенциала (РБА)
объединяет виды C. albicans и С. tropicalis и отличает от C. krusei [12].
Хотя РБА биопленок монокультур кандид хуже выявлялась в сравнении с монокультурами
лактобацилл, она регистрировалась в случае некоторых штаммов C. albicans. В то же время полисахаридная (антигенная)
поверхность дрожжей двух сравниваемых групп (C. albicans + С. tropicalis, C. krusei)
различалась по нашим данным в отношении сродства к маннан- и муцин-связывающим
лектинам пробиотических штаммов бактерий человека (лактобацилл и бифидобактерий)
[8]. По-видимому, в инициации адгезии и росте биопленок на гидрофобных
поверхностях лектиновые адгезины принимают важное участие. Выявленные штаммы
монокультур дрожжей и лактобацилл, способные
снижать пленкообразование смешанными культурами, а также пары штаммов L и Y с
отсутствующим или слабым пленкообразованием являются потенциальными
антагонистами микробных ассоциатов и биопленок in vivo,
заместителями (условно)патогенных ранних биопленок в микробиоценозах биотопов
человека. Взаимовлияние дрожжей и лактобацилл в смешанных культурах указывает
на наличие коммуникационных ранних
сигналов, как со стороны дрожжей, так и со стороны лактобацилл
(появляются уже через 5-7 ч культивирования в питательной среде), в том числе участвующих
в образовании ранних ассоциатных обратимых (поддающихся ресуспендированию в
течение первых суток согласно нашим данным) клеточных биопленок. К коммуникационным
сигналам относятся и лектины – регуляторы клеточного метаболизма, модуляторы
активности ферментов всех известных классов [5]. Более того, лектины
внутриполостных пробиотических бактерий человека имитируют свойства
пробиотиков, являются противобиопленочными
сигналами (относятся к новому классу деструкторов биопленок условно патогенных
микроорганизмов человека), являются членами нового функционального семейства
симбиотических микроорганизмов [10, 11, 13].
ЗАКЛЮЧЕНИЕ
Предложенные подходы к мониторингу раннего пленкообразования
эукариотическими и прокариотическими микроорганизмами и их смесями полезны для
оценки здорового статуса биотопных микробиоценозов человека, отбора новых
источников для клеточной и молекулярной терапии (противобиопленочной,
антипатогенной, альтернативной антибиотикам, иммуномодуляторной, ферментной,
цитокиновой, поддерживающей вспомогательной, комбинированной). Метод
поможет конструированию расширенных по
составу и спектру действия каскадных пролонгированных сетевых с повышенной
надежностью пробиотических консорциумов и компартментов. Получаемые с помощью
метода визуальные паттерны биопленок моно- и смешанных культур в микропанели
являются идентификационными (устанавливающими особенности биопленок моно- и
смешанных культур), прогностическими и диагностичпескими. Они помогают выявлять
ранние нарушения (дисбиотические, другие патологические) функционирования нормофлоры
человека, проводить поиск и обоснование при выборе средств комбинированной
профилактики и терапии. Результаты представляют интерес для разработки микропанельных «комбичипов» в исследовании
и установлении неограниченно протяженных одномерных [в рядах или столбцах
микропанелей] и двумерных паттернов, расширенных по составу консорциумов (штаммовых,
видовых, смешанных), а также штаммов-лидеров по способности модулировать
биопленки и влияющих на результирующее биопленкообразование заданными смешанными
микрокультурами.
ЛИТЕРАТУРА
1.
Лахтин В.М., Корсун В.Ф., Лахтин
М.В., Корсун Е.В. Изучение цитоагглютинирующих активностей (фитолектиновой,
рассасывающей агглютинаты и агглютинирующей цветными примесями) // Практ.
фитотер. - 2004. - № 3. - С. 9 - 16.
2. Лахтин В.М.,
Афанасьев С.С., Алешкин В.А., Несвижский Ю.В., Поспелова В.В., Лахтин М.В и др. Стратегические
аспекты конструирования пробиотиков будущего // Вестник РАМН. - 2008. - № 2. -
С. 33 - 44.
3. Лахтин В.М., Лахтин М.В., Корсун
В.Ф., Шендеров Б.А. Совместный потенциал лектинов пробиотических
микроорганизмов и грибов в условиях организации и функционирования модельных
эукариотических клеточных биопленок - для дальнейшего использования в
клинической практике в составе фитокомпозиций
// Практ. фитотер. - 2008. - № 2. - С. 11 - 17.
4. Лахтин В.М., Лахтин М.В., Агапова
Ю.В., Беликова Ю.В., Кулакова Ю.В., Афанасьев С.С., Алешкин В.А. Преимущества
пробиотического консорциума «Ацилакт» в сравнении с ингредиентными штаммами с
использованием алгоритма ранжирования качеств // Научное пространство Европы: сб. материалов международной НПК, 7-15
апреля, 2012, Польша. – Т. 32. – С. 50-57 (Materiały VIII
Międzynarodowej naukowi-praktycznej konferencji «Naukowa przestrzeń
Europy - 2012» Volume 32. – P.
50-57. Nauk biologicznych.: Przemyśl. Nauka
i studia. ISBN
978-966-8736-05-6).
5. Лахтин М.В., Лахтин В.М., Алешкин
В.А., Афанасьев С.С., Алешкин А.В. Лектины и ферменты в биологии и медицине //
Москва: Издательство «Династия», 2010. - 496 с.
6. Лахтин М.В., Алешкин В.А., Лахтин
В.М., Несвижский Ю.В., Афанасьев С.С.,
Поспелова В.В. Роль лектинов пробиотических микроорганизмов в
жизнеобеспечении макроорганизма // Вестник
РАМН. -
2010. - № 2. - С. 3 - 8.
7. Лахтин М.В., Алешкин В.А., Лахтин
В.М., Галимзянов Х.М., Афанасьев С.С., Караулов А.В., Несвижский Ю.В.,
Байракова А.Л., Воропаева Е.А., Алешкин А.В. и др. Поведение патогенных грибов
рода Candida разных видов в присутствии пробиотических
лектинов // Астраханский медицинский журнал. – 2011. – № 2. – С. 73 – 76.
8. Лахтин М.В., Алешкин В.А., Лахтин
В.М., Афанасьев С.С., Караулов А.В., Галимзянов Х.Л., Несвижский Ю.В.,
Байракова А.Л., Воропаева Е.А., Алешкин А.В. и др. Поведение Candida tropicalis и Candida krusei
в присутствии пробиотических лектинов
// Астраханский медицинский журнал. – 2011. – № 3. – С. 97-101.
9. Лахтин М.В., Байракова А.Л., Лахтин
В.М., Алешкин А.В., Афанасьев С.С.,
Алешкин В.А. Кофункционирование лектинов мультикомпонентного пробиотика
и потенциального пробиотического компартмента биотопа на примере авторегуляторной
лактобациллярной системы // Бюлл. ВСНЦ СО РАМН. - 2012. - № 5 (87); Часть 1. –
С. 250 – 253.
10. Lakhtin
M., Aleshkin V., Lakhtin V., Afanasiev S., Pozhalostina L., Pospelova V.
Probiotic lactobacillus and bifidobacterial lectins against Candida albicans and Staphylococcus aureus clinical strains:
new class of pathogen biofilm destructors // Probiotics & Antimicrobial
Proteins. – 2010. – Vol. 2, N 3. – P. 186 – 196. DOI:
10.1007/s12602-010-9046-3.
11. Lakhtin M., Lakhtin V.,
Aleshkin V., Afanasiev S. Lectins of beneficial microbes: system organization,
functioning and functional superfamily // Beneficial Microbes. - 2011. – Vol. 2, N 2. – P. 155 – 165. DOI: 10.3920/BM2010.0014.
12. Lakhtin M., Lakhtin
V., Bajrakova A., Aleshkin A., Аfanasiev S., Aleshkin V. Interaction of
probiotic bacterial lectins to Candida species // Науки и технологии:
шаг в будущее: материалы VIII международной НПК, 27
февраля – 5 марта, 2012, Чешская республика. - Том 29. – С. 34-41 (Materiály
VIII mezinárodní
vědecko - praktická
conference «Věda
a technologie: krok
do budoucnosti - 2012». - Díl
29. Biologické vědy: Praha. Publishing House
«Education and Science» s.r.o. ISBN 978-966-8736-05-6).
13. Lakhtin M., Lakhtin V., Aleshkin A., Bajrakova A., Afanasiev S.,
Aleshkin V. Lectin systems imitating probiotics:
potential for biotechnology and medical microbiology // In: “Probiotics 2012”, Edited
by E.C. Rigobelo, http://dx.doi.org/10/5772/3444.
– 2012. – P. 417 – 432. ISBN 978-953-51-0776-7.
А B
C D
E 1 2 3 4
5 6 7
8 9 10
A B C D E 1 2 3 4 5 6 7

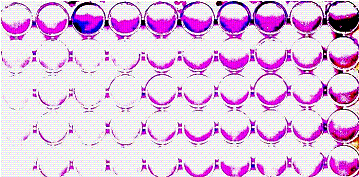
Рисунок 1. Примеры сканов биопленок различных штаммов кандид (слева) и лактобацилл (справа). A-Е – условия роста монокультур в среде MRS.
Таблица 1
Биопленкообразование
смешанными культурами кандид и лактобацилл
|
№шт |
L1 |
L2 |
L3 |
L4 |
L5 |
L6 |
L7 |
L8 |
L9 |
L10 |
L11 |
L12 |
L 1-12 |
|
Y1 |
170 ±49 |
110 ±22 |
128 ±80 |
100 ±77 |
120 ±37 |
92 ± 91 |
138 ±94 |
914 ±411 |
253 ±89 |
228 ±17 |
223 ±205 |
342 ±23 |
235 ±226 |
|
Y2 |
145 ±57 |
113 ±17 |
95 ± 8 |
62 ±38 |
94 ±33 |
60 ±48 |
131 ±105 |
376 ±193 |
250 ±75 |
189 ±16 |
342 ±231 |
229 ±20 |
174* ±106 |
|
Y3 |
174 ±74 |
74 ±68 |
58 ±42 |
54 ±33 |
108 ±36 |
10 ±9 |
137 ±132 |
640 ±436 |
190 ±34 |
96 ±22 |
295 ±185 |
305 ±16 |
178* ±172 |
|
Y4 |
105 ±26 |
41 ±39 |
64 ±59 |
36 ±33 |
69 ±1 |
12 ±7 |
78 ±35 |
291 ±32 |
168 ±18 |
100 ±60 |
90 ±61 |
108 ±99 |
97* ±73 |
|
Y5 |
117 ±37 |
55
±54 |
53 ±31 |
38 ±33 |
70 ±37 |
24 ±21 |
85 ±25 |
314 ±97 |
136 ±54 |
50 ±20 |
100 ±43 |
160 ±97 |
100* ±79 |
|
Y6 |
143
±53 |
47 ±37 |
94 ±35 |
42 ±23 |
72 ±35 |
39 ±14 |
128 ±71 |
319 ±149 |
159 ±61 |
82 ±39 |
207 ±114 |
268 ±13 |
133* ±91 |
|
Y7 |
347 ±253 |
224 ±77 |
279 ±158 |
304 ±183 |
331 ±25 |
219 ±49 |
335 ±128 |
366 ±185 |
306 ±12 |
198 ±99 |
483 ±323 |
522 ±18 |
*326 ±98 |
|
Y8 |
187 ±57 |
120 ± 26 |
147 ±34 |
97 ±80 |
82 ±39 |
114 ±75 |
209 ±81 |
603 ±285 |
198 ±95 |
162 ±84 |
175 ±97 |
165 ±12 |
188* ±137 |
|
Y 1-8 |
*173* ±75 |
98* ±60 |
115* ±74 |
92* ±89 |
118* ±88 |
71* ±70 |
*155* ±83 |
*477 ±220 |
*208* ±57 |
138* ±64 |
*239* ±131 |
*262* ±130 |
- |
Примечание: Даны значения D620 х 103 (за
вычетом фона) поглощения в лунках микропанели (NUNC, NUNCLON).
Ряды соответствуют дрожжевым (Y) штаммам кандид , а столбцы
– штаммам лактобацилл (L). *Достоверность
различия (P< 0.05) рассчитана в сравнении с максимальным («справа*»)
или минимальным («*слева») значением в ряду или столбце.