УДК 636.5.084:612
ИСПОЛЬЗОВАНИЕ СОЕВОЙ ОКАРЫ В КАЧЕСТВЕ
БЕЛКОВОЙ ДОБАВКИ СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЕ
Дежаткина С.В., Ахметова В.В., Силова Н.В., Писалева С.Г.
ФГБОУ ВПО «Ульяновская ГСХА им. П.А. Столыпина»
На современном этапе развития
науки проблема белкового питания является особо актуальной. На сегодняшний день
ученые и птицеводы ищут новые источники энергии и протеина, которые были бы
доступными и дешевыми, а также эффективными. Среди белковых добавок широко
применяют жмыхи и шроты, содержащие до 35…50% сырого протеина и улучшающие
яйценоскость и развитие птицы [1, 8]. Использование ферментных препаратов с учетом зерно-злаковой
основы рациона, а также в комплексе с цеолитом, позволяет существенно повысить
рентабельность птицеводства и положительно влияет на воспроизводительную
способность птиц [2]. В качестве растительных
белковых кормов в птицеводстве используют также горох, кормовые бобы, люпин, вику
и сою, в них высокое содержание протеина и аминокислот, а также отходы переработки
семян рапса и подсолничника. Добавляют в рационы птиц отходы и от переработки
животноводческой продукции, в том числе мясо-костную муку, перьевую муку,
мясо-перьевую муку, кератиновые отходы (малоценное перо, волосы, рога, копыта)
и другие [3, 8].
Соевые бобы содержат до 40% сырого протеина, с высоким уровнем лизина, метионина, но сдерживающим фактором использования сырых соевых бобов в птицеводстве является высокое содержание в них ингибиторов трипсина, которые вызывают снижение использования питательных веществ рациона и продуктивности, поносы и падеж птицы. На молочных заводах в результате отжима соевого молока на фильтр-прессе получают не токсичный отход производства - соевый жмых (окару), пищевая ценность которого определяется высококачественной белковой фракцией, липидным комплексом, углеводами, пищевыми волокнами, широким спектром макро- и микроэлементов, витаминов и антиоксидантов, имея низкую себестоимость производства [1, 6, 7].
Целью исследования стало изучение показателей крови, печени и
продуктивности кур-несушек при добавлении
в их рацион соевой окары.
Материал и методы исследования.
Для достижения поставленной
цели провели физиологический опыт на курах-несушках породы Хайсекс (150 дн. возраста) в личном хозяйстве Засвияжского района Ульяновской области РФ.
1. Схема
опыта
|
Группа |
Возраст, дни |
Поголовье |
Условия опыта |
|
|
начало опыта |
конец опыта |
|||
|
1-я контрольная |
150 |
240 |
10 |
Основной рацион (ОР) |
|
2-я опытная |
150 |
240 |
10 |
ОР + соевая окара |
Содержание кур было
групповым, со свободным доступом к воде и пище, опыт проводили в течение трех
месяцев. В группу птиц формировали по 5 голов, одинаковых по возрасту, живой
массе и продуктивности (схема 1). Биохимические
показатели изучали по
общепринятым методикам, используя биохимический
анализатор Stat Fax.
Для гистологического
исследования печени проводили убой птиц в количестве 5 голов из группы.
Материал фиксировали в 10%-ном забуференном формалине и заливали в парафин, с помощью санного микротома готовили
срезы толщиной 5…6 мкм, которые окрашивали по общепринятой методике
гематоксилином и эозином. Для окрашивания и выявления соединительных тканей
использовали метод Ван-Гизон, при котором коллагеновые волокна окрашиваются в
ярко-розовый цвет.
Результаты исследований
Анализ полученных данных показал, что введение в рацион сельскохозяйственной
птицы соевой окары как дополнительного источника белка оказало положительное
влияние на уровень биохимических показателей в их крови. Выявлено достоверное
увеличение в рамках физиологических норм содержания глюкозы в крови кур опытной
группы на 14% (p<0,05)
по сравнению с контролем, указывая на усиление процессов гидролиза углеводов с
образованием дополнительной энергии.
Аналогично изменялась концентрация общего белка в сыворотке крови кур
2-й группы (табл.2), соответственно выражено возрастала на 17,2% (р>0,05),
свидетельствуя о повышении белкового обмена, при введении в рацион кур соевой
окары. Это подтверждается достоверным понижением в рамках норм концентрации
продуктов азотистого обмена (табл.2), в том числе мочевины в крови кур опытной
группы на 30% (p<0,05),
креатинина на 12,4% (p<0,05),
билирубина на 10,4% (р>0,05) по сравнению с данными в контроле. Вероятно,
введение белковой соевой окары курам опытной группы способствовало усилению
биосинтеза белка и положительному азотистому балансу.
2. Биохимические показатели крови кур, n = 5
|
Группы животных |
Общий белок , г/л |
Креатинин, мкмоль/л |
Мочевина, ммоль/л |
Билирубин, мкмоль/л |
Холестерин, ммоль/л |
|
1 - контроль |
34,90+2,23 |
130,14+4,36 |
0,20+0,03 |
6,56+0,89 |
0,89+0,08 |
|
% |
100 |
100 |
100 |
100 |
100 |
|
2 - ОР + соевая окара |
40,90+3,01 |
115,34+4,02* |
0,14+0,05* |
5,88+0,97 |
1,27+0,08** |
|
% от контроля |
117,19 |
88,63 |
70,00 |
89,63 |
142,70 |
*р<0,05, **р<0,01
В ходе опыта изменялся уровень холестерина в крови кур
при скармливании соевой окары (табл. 2), достоверно возрастая в опытной группе
в рамках физиологических норм на 42,7% (р<0,01) по отношению к контролю, что
говорит о стимуляции образования липоидов в печени птицы.
3. Содержание кальция и фосфора в крови кур, n = 5
|
Группы животных |
Кальций ммоль/л |
Фосфор, ммоль/л |
|
1 - контроль |
2,75+0,67 |
1,78+0,23 |
|
% |
100 |
100 |
|
2 - ОР + соевая окара |
3,16+1,29 |
2,05+0,73 |
|
% от контроля |
114,91 |
115,17 |
(р>0,05)
Уровень кальция и фосфора в крови птицы
2-й группы, где использовали соевую
окару, имел выраженную тенденцию к увеличению соответственно на 14,9% и 15,2%,
по отношению к контролю (табл. 3). Повышение уровня кальция в крови птиц во
время яйцекладки следует рассматривать как фактор, обеспечивающий
транспортировку запасных продуктов для синтеза протеинов яичного желтка и
образование скорлупы.
Все изменения, произошедшие в крови
кур-несушек опытных групп, в дальнейшем положительно отразились на характере
продуктивности птицы.
4. Показатели продуктивности кур-несушек кросса Хайсекс, n = 10
|
Показатели |
1 контрольная |
2 опытная |
|
Живая масса кур-несушек (в начале опыта), г |
1663 |
1673 |
|
Живая масса кур-несушек (ч/з 30 дн.), г |
1750 |
1776 |
|
Живая масса кур-несушек (ч/з 60 дн.), г |
1776 |
1818 |
|
Живая масса кур-несушек (ч/з 90 дн.), г |
1798 |
1852 |
|
Интенсивность яйценоскости (в начале опыта), % |
74 |
74 |
|
Интенсивность яйценоскости (в конце опыта), % |
85 |
93 |
Скармливание курам-несушкам кросса «Хайсекс»
комбикорма с добавлением соевой окары, позволило повысить живую массу птиц к
концу эксперимента на 179 г, по сравнению с первоначальной массой, тогда как в
контроле этот показатель отличался на 135 г. и интенсивность их яйценоскости от
74% (в начале опыта) до 93% во 2-й группе и до 85% в 1-й (в конце периода) (табл.
4).
Гистологические
исследования печени кур показали, что у
птиц контрольной группы, получавшей основной рацион, от центральной вены дольки
печени формируются печеночные балки к периферии (рис. 1). Гепатоциты с
центрально расположенным ядром -округлой формы. Цитоплазма гепатоцитов
окрашивается базофильно, что свидетельствует о высокой функциональной
активности (рис. 2).
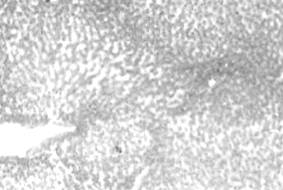
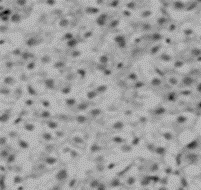
|
Рис. 1. Балочное строение дольки печени курицы контрольной группы, получающей основной рацион. Окраска гематоксилин – эозином. Ок. 10, об. 20. |
Рис. 2. Гепатоциты печени курицы контрольной
группы, получающей основной рацион.
Окраска гематоксилин – эозином. Ок. 10, об. 40.
Между печеночными
балками располагаются внутридольковые синусоидные капилляры. Хорошо
определяются периваскулярные пространства. Междольковая соединительная ткань
слаборазвита, и в ней проходит триада: междольковый желчный проток, междольковая артерия и междольковая вена.
В печени второй группы
птиц, получавших добавку соевую окару, обнаруживаются определенные изменения,
хотя в целом печень имеет нормальное гистологическое строение. Гепатоциты без
существенных изменений. Ядра гепатоцитов округлой формы, располагаются в центре
клетки, окрашиваются базофильно, тогда
как цитоплазма - оксифильно.
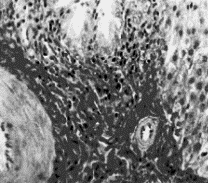
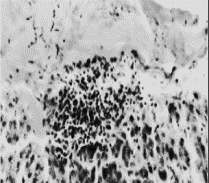
|
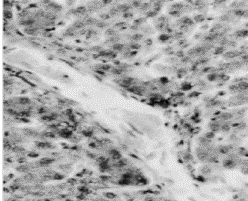
Рис. 3. Междольковая соединительная ткань в триаде печени курицы
второй группы, получавшей ОР и соевую окару.
Окраска по Ван-Гизон. Ок.10, об.40. |
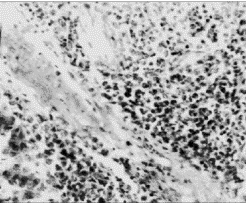
Рис. 4. Небольшое скопление лейкоцитов под
соединительнотканной капсулой
печени курицы
второй группы, получавшей ОР и соевую
окару.
Окраска гематоксилином и эозином.
0к.10, об.40.


|
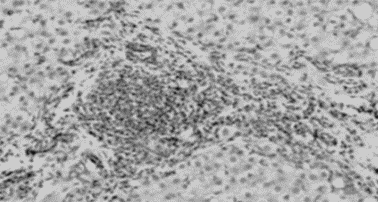
Рис. 5. Скопление
клеток крови в междольковой соединительной ткани печени курицы второй группы,
получавшей ОР и соевую акару. Окраска гематоксилином и эозином. 0к.10,
об.40. |
Рис. 6. Умеренное кровенаполнение сосудов
печени курицы второй группы, при применении
соевой окары с ОР. Окраска гематоксилином -
эозином. Ок.10, об.40.
Как видно на рисунке 3 в
зоне расположения триады печени хорошо развита рыхлая междольковая
соединительная ткань. Небольшого размера скопления лейкоцитов встречаются и
под капсулой печени и инфильтрируют печеночные пластинки, а также
соединительнотканные прослойки (рис. 4). Вместе
с тем встречаются участки долек печени со скоплением клеток крови в междольковой
соединительной ткани (рис. 5). Небольшие
скопления лимфоидных клеток диффузно располагаются в различных участках печени,
что является гистологической особенностью строения печени кур (рис. 6).
Кровеносные сосуды различного калибра, умеренного кровенаполнения.
|
Рис. 7. Переполненный
кровью кровеносный сосуд и сдавленные
гепатоциты печени курицы второй группы, получавшей ОР и соевую акару. Окраска
гематоксилином и эозином. 0к.10, об.40. |
Лимфоциты и макрофаги диффузно распространяются в
окружающие тканевые структуры печени. При этом скопление лимфоидных клеток
располагается в непосредственной близости от венозного сосуда и, возможно,
оказывает на него давление. Вероятно, давление оказывается и на печеночные
пластинки, деформируя их расположение (рис. 7). При этом нарушается ход печеночных
пластинок, что может вызывать затруднение кровообращения и желчеотделения в
печени. Чем можно объяснить повышение уровня холестерина на 42,7% (р<0,01) в
сравнении с контролем, это подтверждает
стимуляцию образования липоидов в печени. В непосредственной близости от
переполненных кровью кровеносных сосудов и скопления лимфоцитов цитоплазма
гепатоцитов слабо прокрашивается, а сами клетки теряют четкость границ. Можно
предположить, что в гепатоцитах происходит изменение метаболизма. Также наблюдается
появление в цитоплазме клеток печени жировых включений.
Заключение. Обогащение рационов кур соевой окарой способствует повышению
белкового обмена, что приводит к морфологическим изменениям гепатоцитов
печени.
Литература:
1. Дежаткина С.В. Соевые отходы производства
в свиноводстве / С.В. Дежаткина, А.З.
Мухитов. // Ученые записки Казанской государственной академии
ветеринарной медицины им. Н.Э. Баумана.- Том 206. - 2011. - С. 55-60.
2. Ерисанова О.Е. Товарные и
пищевые качества яиц кур при использовании препарата Коретрон / О.Е. Ерисанова,
В.Е. Улитько, А.Г. Ариткин.
//Зоотехния. - № 1. - 2011. – С. 27-29.
3. Околелова Т. Качественная
кормовая рыбная мука нужна птицеводству /Т.Околелова, Р. Мансуров, В. Бевзюк
//Птицеводство. - 2011. – №12. – С. 6-7.
4. Кондрахин И.П. Методы ветеринарной
клинической лабораторной диагностики. Справочник /И.П. Кондрахин/.- М.: Колос
С. - 2004. - 520с.
5. Коржевский Д.Э., Основы
гистологической техники / Д.Э. Коржевский, А.В. Гиляров. – М.: СпецЛит, 2010 –
С 16 – 23.
6. Любин Н. Соевые отходы – в кормовые ресурсы /Н. Любин, А. Дозоров,
С. Дежаткина, А. Мухитов А. // Животноводство России, № 12, 2011. – С. 24-29.
7. Садовой В.В. Соевая пища окара в композиционных
рецептурах мясных изделий /В.В. Садовой, В.А. Самылина. //Известия вузов.
Пищевая технология. 2005, №1. – С. 46-48.
8. Фаритов Т.А. Корма и кормовые добавки /Т.А.
Фаритов.- СПб.: Издательство «Лань». – 2010. – 304 с.
9. Хуснутдинов Р. Р., Гистологическая характеристика
печени кур при применении токоферола и фасоли / Р. Р. Хуснутдинов, Е. С.
Волкова // Известия
Оренбургского государственного аграрного университета, № 4, 2006. – С.
21 – 23.