Химия и химические технологии / 5. Фундаментальные проблемы создания новых материалов и технологий
*Короткая
Е.А., к.х.н. *Бондарев Н.В., к.х.н. **Зайцева И.С.
*Национальный
университет имени В.Н. Каразина, Харьков, Украина
**Харьковская
национальная академия городского хозяйства, Украина
Моделирование электрохимических
свойств мицеллярных растворов катионных
ПАВ при распределении слабых кислот
В современной термодинамической интерпретации
растворов мицеллярных электролитов, к которым относятся мыла, красители,
алкалоиды и др., широко используется два подхода: гомогенная трактовка
равновесий между молекулами или ионами и образующимися из них мицеллами и
гетерогенная трактовка, основанная на фазовом равновесии водный раствор /
псевдофаза, условием которого является равенство электрохимических потенциалов
ионов в сосуществующих фазах. При этом под псевдофазой понимается совокупность
мицелл, для которых числа агрегации от 30 до 2000 (число молекул (ионов) в мицелле).
Целью работы является моделирование Гальвани-потенциала границы
раздела мицеллярная фаза / водный раствор при распределении слабой кислоты на
основе уравнения взаимосвязи Гальвани-потенциала с первичными эффектами среды,
первичными солевыми эффектами и равновесными концентрациями ионов и молекул
слабой кислоты.
В случае, когда карбоновая кислота (НА)
распределяется между водным раствором и мицеллами катионных ПАВ,
нейтрализующими заряд анионов карбоновой кислоты в мицелле
(адсорбционно-нейтрализационный механизм образования двойного электрического
слоя на границе раздела фаз), потенциалопределяющими ионами становятся ионы
водорода.
В
условиях равновесия ![]() или
или ![]() =
=
![]() и для равновесного
Гальвани-потенциала на границе раздела водный раствор / мицеллярная фаза можно
записать
и для равновесного
Гальвани-потенциала на границе раздела водный раствор / мицеллярная фаза можно
записать
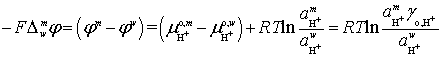
Таким образом, при распределении ионов H+
между водным раствором кислоты и мицеллярным раствором кислоты химическая энергия превращается в
электрическую ![]() .
.
Взаимосвязь между термодинамическими
константами диссоциации кислоты НА в водном (w) и мицеллярном (m)
растворах вытекает из рассмотрения термодинамического цикла, записанного для
кислотно-основных равновесий кислоты НА
в водной и мицеллярной фазах:
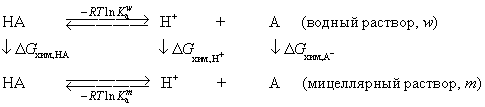
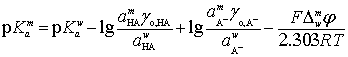
Тогда уравнение, характеризующее влияние первичных
эффектов среды, равновесных концентраций частиц и ионной силы раствора
(первичного солевого эффекта) на Гальвани-потенциал границы водный раствор /
мицеллярная фаза приобретает вид
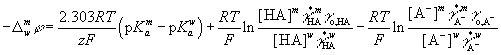
Согласно Н.А. Измайлову, константы диссоциации кислоты
НА в стандартном водном и мицеллярном растворах связаны соотношением
![]()
Откуда
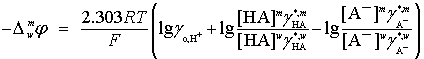 или
или
![]()
На примере уксусной кислоты (рис. 1) показано влияние
коэффициента распределения (К) и эффектов среды на
Гальвани-потенциал модельной псевдофазы.
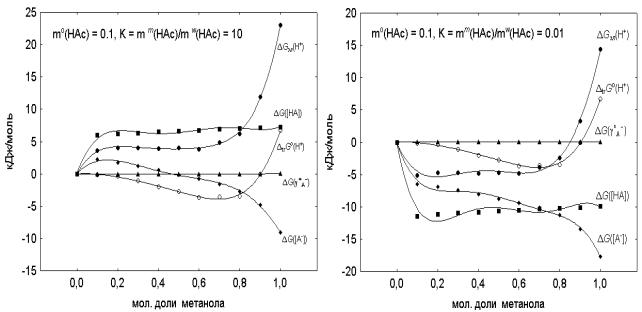
Рис. 1. Влияние
первичных эффектов среды (![]() ), коэффициентов активности
(
), коэффициентов активности
(![]() ), равновесных концентраций ионов и молекул уксусной кислоты (
), равновесных концентраций ионов и молекул уксусной кислоты (![]() )на Гальвани-потенциал
)на Гальвани-потенциал ![]() модельной псевдофазы
модельной псевдофазы
Термодинамическим критерием устойчивости модельной
микрогетерогенной системы является самопроизвольный переход химической энергии
в электрическую![]() ,
,![]() . Тогда
адсорбционно-нейтрализационной концепции образования ДЭС на границе водный
раствор /псевдофаза отвечают такие условия (рис. 1): коэффициент распределения
карбоновых кислот между фазами меньше 0.1; стандартное состояние протона в
псевдофазах идентично стандартному
состоянию в водно-метанольных растворителях с содержанием спирта 0.1 ≤ XMeOH ≤ 0.8. Показано, что причинами устойчивости
модельной псевдофазы являются первичные эффекты среды для протона и концентрационные
эффекты молекул карбоновых кислот (рис.1), изменение начальной концентрации
кислот в микрогетерогенных средах практически не влияет на Гальвани-потенциал,
а увеличение ионной силы водного раствора повышает межфазный потенциал
модельной микрогетерогенной системы.
. Тогда
адсорбционно-нейтрализационной концепции образования ДЭС на границе водный
раствор /псевдофаза отвечают такие условия (рис. 1): коэффициент распределения
карбоновых кислот между фазами меньше 0.1; стандартное состояние протона в
псевдофазах идентично стандартному
состоянию в водно-метанольных растворителях с содержанием спирта 0.1 ≤ XMeOH ≤ 0.8. Показано, что причинами устойчивости
модельной псевдофазы являются первичные эффекты среды для протона и концентрационные
эффекты молекул карбоновых кислот (рис.1), изменение начальной концентрации
кислот в микрогетерогенных средах практически не влияет на Гальвани-потенциал,
а увеличение ионной силы водного раствора повышает межфазный потенциал
модельной микрогетерогенной системы.