Зоркин А.Я.,
Семенов С.В., Вавилина Н.А.
Саратовский
государственный технический университет имени Гагарина Ю.А., Россия
Критерии эмиссионной активности оксидосодержащих катодов вакуумных электронных приборов
В современных вакуумных электронных
приборах (ВЭП) широко применяют оксидосодержащие катоды [1]. Для контроля эмиссионной активности оксидосодержащих катодов в
процессе технологических операций откачки и тренировки ВЭП необходимы критерии
эмиссионной активности [1].
Критерием
эмиссионной активности катода может служить отношение фактического давления
кислорода к давлению кислорода в точке минимума общего равновесного давления
над оксидом:
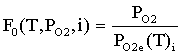 ,
,
где F0(T,PO2,i) - критерий эмиссионной активности
катода (КАОК); PO2 - фактическое давление кислорода, атм; PO2e(T)i - давления кислорода в точке минимума
общего равновесного давления над оксидом, атм; T - температура катода, К; I - индекс оксида (i = Y, Ba, Th соответственно для Y2O3, BaO и ThO2).
Давление
кислорода в точке минимума общего равновесного давления над оксидом
определяется из решения уравнения:
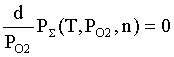 ,
,
где P∑(T,PO2,n)
- общего равновесного давления над оксидом ; n
- номер оксид образующего
элемента по периодической таблице элементов Менделеева (n = 39, 56, 90 соответственно для Y, Ba, Th).
Если
процесс откачки и тренировки прибора контролируется по отношению парциальных
давлений СО2 / СО и Н2О / Н2 , то фактическое
давление кислорода в приборе соответственно равно:
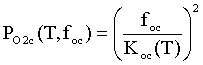 ,
,
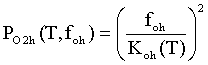 ,
,
где foc=PCO2/PCO; foc=PH2O/PH2; PO2c(T,foc), PO2h(T,foh) - давление молекулярного кислорода в
приборе при заданных отношениях давлений СО2 / СО и Н2О /
Н2 , атм; Koh(T),
Koc(T)
- константы равновесия реакций СО + 0.5 О2 = СО2
и Н2 + 0.5 О2 = Н2О.
Если
фактическое давление кислорода становится меньше давления кислорода в точке
трехфазного равновесия металл – оксид – газ, то оксид начинает разлагаться до
чистого металла или с образованием растворов с подложной. Давление кислорода в
точке трехфазного равновесия раствор – оксид – газ при активности металла равной единице определяется по формуле:
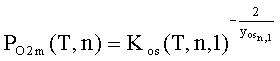 ,
,
где PO2m(T,n) - давление кислорода в точке
трехфазного равновесия металл – оксид – газ, атм; Kos(T,n,1) - константа равновесия реакции образования
оксида из простых веществ xos М(s)
+ yos/2 O2 = Mxos Oyos(s).
Условием
активности катода является неравенство:
Fo(T,PO2,i)<1.
На
рис. 1 и 2 показаны зависимости КАОК от температуры катода при отношениях
давлений СО2 / СО и Н2О / Н2 равных foc=10-5 и foh=10-5. Это минимальные
значения foc и
foh, которые наблюдаются при измерении парциальных давлений
омегатроном в конце процесса откачки.
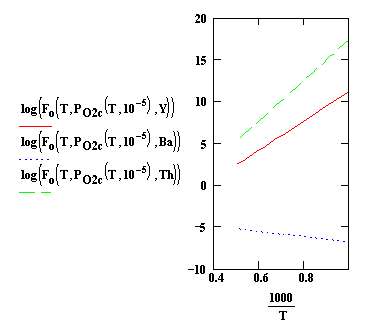
Рис. 1. Зависимости КАОК от температуры при отношении давлений
СО2 / СО равном
foc=10-5. 1 - Y2O3,
2 - BaO; 3 - ThO2
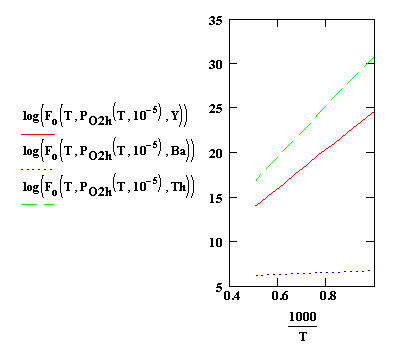
Рис. 2. Зависимости КАОК от температуры при отношениях давлений
Н2О / Н2
равном foh=10-5. 1 - Y2O3;
2 - BaO; 3 - ThO2
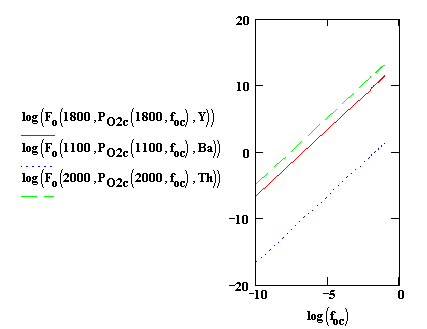
Рис. 3. Зависимости КАОК от значений foc при рабочих температурах катодов, содержащих: 1 - Y2O3 (1800К); 2 - BaO (1100К); 3 - ThO2 (2000К)
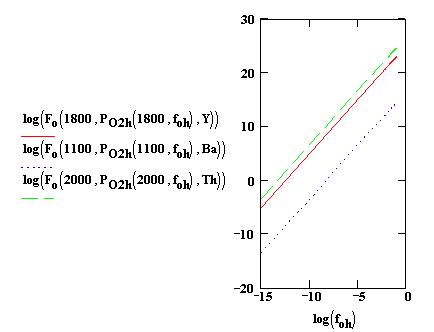
Рис. 4. Зависимости КАОК от значений foh при рабочих температурах катодов, содержащих: 1 - Y2O3 (1800К); 2 - BaO (1100К); 3 - ThO2 (2000К)
Из
рис. 1 и 2 видно, что катоды на основе Y2O3 и ThO2 при таких значениях foc и foh еще не активированы. Однако эмиссия в
конце процесса откачки достаточно высока, поэтому фактические значения
отношений foc и
foh в приборе должны быть значительно меньше вследствие
активности титанового геттера. Несоответствие расчетных значений с экспериментальными
можно объяснить значительным удалением омегатронного датчика от прибора и
различием температур датчика и катода (с уменьшением температуры отношения foc и foh увеличиваются). Таким образом, контроль
активности катодов с помощью омегатрона требует специальной градуировки
измерительной системы.
На
рис. 3 и 4 приведены зависимости КАОК от значений foc и foh при рабочих температурах катодов,
содержащих Y2O3 (1800К), BaO (1100К), ThO2 (2000К).
Литература
1.
Откачка
электронных приборов / А.Я. Зоркин, Г.В. Конюшков. – Саратов: СГТУ, 2006. – 284
с.