Зоркин А.Я.,
Семенов С.В., Вавилина Н.А.
Саратовский
государственный технический университет имени Гагарина Ю.А., Россия
Адсорбционный механизм образования
поверхностного заряда в термоэлектронных оксидосодержащих катодах вакуумных электронных
приборов
Низкая работа выхода
активированного оксидосодержащих
катодов вакуумных электронных приборов обеспечивается в значительной степени
поверхностным потенциалом [1].
Поверхностный потенциал, изгибающий зоны вблизи поверхности оксида, образуется
за счет появления положительного поверхностного заряда. Природа поверхностного
заряда на оксидах в настоящее время не выяснена [1]. Одним из возможных механизмов образования положительного
заряда является адсорбция и ионизация атомов бария на поверхности оксида.
Известно, что реконструкция поверхности ионных кристаллов оксидов незначительна
в отличие от поверхности ковалентных
кристаллов [1]. Поэтому
адсорбированные атомы бария можно считать продолжением кристаллической решетки
оксида, а их внешние электронные уровни
– расположенными вблизи дна зоны проводимости. Вследствие низкой активности
кислорода (давления молекулярного кислорода) в активированном оксиде адсорбцией
атомов кислорода, создающих отрицательный поверхностный заряд, можно пренебречь [2].
Для определения
положительного поверхностного заряда, образованного адсорбированными атомами
бария, рассмотрим равновесное состояние системы оксид – пары оксида [1-3]. Фазовое равновесие двухкомпонентной
двухфазной системы определяется двумя параметрами, в качестве которых возьмем
температуру и активность кислорода. Таким образом, все параметры системы, в том числе поверхностный потенциал и заряд,
можно представить функциями температуры и активности (давления) кислорода. Так как
эффективный заряд частиц в узлах ионной решетки не превышает единицы [1], то
степень ионизации адсорбированных атомов принята равной единице. Поверхностный
заряд равен [1-3]:
|
|
(1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где ηq(T,PO2),
η0(T,PO2) - степень ионизации
и доля нейтральной формы адсорбированных атомов металла; Фs(T,PO2), ϕFc(T,PO2) - внутренняя работа выхода на поверхности
и в объеме; ϕys(T,PO2) -
поверхностный потенциал (все энергетические параметры взяты по абсолютной
величине); NM(T,PO2) - общее число адсорбированных
атомов металла на единице поверхности; PMg(T,PO2) - давление атомарных паров металла; KMg(T) - константа
равновесия реакции разложения твердого оксида на атомарные пары металла и
молекулярный кислород МО = М + 0.5 О2; Nn=aox-2- поверхностная концентрация
структурных единиц МО; aox
- параметр решетки оксида; mM-
масса атома металла; kn
- коэффициент прилипания; Ed
- энергия активации десорбции; T
- абсолютная температура; PO2 - давление кислорода (атм); PA - атмосферное
давление, Па; ν(T)=k∙T/h - частота колебаний атомов на
поверхности; h -
постоянная Планка; k - постоянная Больцмана; e’ - заряд электрона.
Поверхностный потенциал
можно связать с поверхностным зарядом также из решения уравнения Пуассона [1]:
|
|
(2) |
|
|
|
где nec(T,PO2)
- концентрация электронов проводимости в объеме оксида; ε0, ε - диэлектрическая постоянная и относительная диэлектрическая проницаемость оксида.
Внутренняя работа выхода
связана с концентрацией электронов проводимости в объеме оксида соотношением:
|
|
(3) |
|
|
|
где
Nc(T) - объемная
плотность состояний в зоне
проводимости оксида; me - эффективная масса электрона.
Приравнивая левые части
выражений (11) и Ошибка! Источник ссылки не найден.2) с учетом приведенных соотношений после
преобразования найдем поверхностный потенциал как функцию температуры и
давления молекулярного кислорода в газовой фазе:
|
|
|
,
где Yr(T,PO2) - решением
следующего уравнения относительно y
|
|
|
где Qso=Nn∙e’.
Для малых покрытий ϕys(T,PO2) примет вид [1]
|
|
(4) |
Концентрация электронов
проводимости в объеме оксида находится независимо из решения уравнения
электронейтральности в объеме оксида с учетом уравнений баланса структурных
единиц или статистическим методом [4, 5]. В случае преобладания кислородных вакансий над металлическими
концентрацию свободных электронов в зоне проводимости оксида можно определить
по формуле:
|
|
(4) |
|
|
|
|
|
|
где V2O(T,PO2) - концентрация
двукратно ионизированных вакансий кислорода в оксиде; N0=ρMO∙NA/MMO -
объемная концентрация структурных единиц МО в оксиде; ρMO,
MMO
- плотность и молярная масса оксида; NA - число Авогадро; Kν(T) - константа
равновесия реакции МО = 2 е + V2O + 0.5 O2 (в реакции
обозначено: МО – твердый оксид, V2O - двукратно
ионизированные кислородные вакансии, MM – ионы металла в узлах решетки; O2 – молекулярный кислород в
газовой фазе).
Внешняя работа выхода
оксида равна
|
|
(5) |
где χs
- сродство оксида к электрону на поверхности; δ- дипольная составляющая работы выхода.
Из выражений Ошибка! Источник ссылки не найден.3), Ошибка! Источник ссылки не найден.4) и Ошибка! Источник ссылки не найден.5) видно,
что работа выхода при малых покрытиях не зависит от концентрации электронов в
объеме оксида и, следовательно, от температуры и активности кислорода.
На рис. 1 показаны
зависимости поверхностного потенциала, внутренней и внешней работы выхода от
температуры, а на рис. 2 – от
давления молекулярного кислорода для оксида бария. Сродство к электрону принято
равным 1,1 эв, дипольная составляющая
0,1 эв, а энергия активации десорбции
адсорбированных атомов бария в нейтральной форме 3,5 эв.
3 2 1
![]()
![]()
![]()
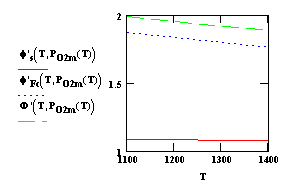
Рис. 1. Зависимости поверхностного потенциала (1), внутренней (2) и
внешней (3) работы выхода (эв) от температуры (К) для оксида бария на линии
минимума общего давления паров оксида
3 2 1![]()
![]()
![]()
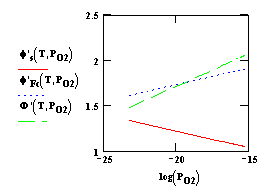
Рис. 2. Зависимость поверхностного потенциала (1), внутренней (2) и
внешней (3) работы выхода (эв) от давления молекулярного кислорода (атм) для оксида
бария при Т=1100 К
При температуре 1100 К и
давлении молекулярного кислорода более 10-19 атм внешняя работа
выхода больше внутренней, а при давлении менее 10-19 атм –меньше, то есть при низкой активности кислорода
объемное сродство оксида к электрону отрицательно. Так как внутренняя работа
выхода активированного оксида равна высоте барьера Шоттки в контакте металл – оксид [1] ,
то при низкой активности кислорода лимитирующим является барьер Шоттки в этом
контакте.
Литература
1. Зоркин
А.Я. Адсорбционный механизм образования поверхностного заряда и работа выхода
оксидного катода // Перспективные направления развития
электронного приборостроения. – Саратов: Сарат. гос. ун.-т, 2003. – С. 108 – 113.
2. Зоркин А.Я. Равновесие оксид – газ, состояние
поверхности и работа выхода оксидного катода // Вакуумная наука и техника:
Материалы 10-ой международной научно-технической конференции. –/М.: МИЭМ, 2003. – С. 69 – 74.
3. Волькенштейн
Ф.Ф. Электронные процессы на поверхности полупроводников при хемосорбции. – М:
Наука, 1987. –
432 с.
4. Крегер
Ф. Химия несовершенных кристаллов. – М: Мир, 1969. – 655 с.
5. Браун
О.М., Пикус Г.Я., Чайка Г.Е. Расчет динамически равновесного состава и
электропроводности кристаллов при высокой температуре в вакуумем // Физика
твердого тела, вып. 9, 1975. –
С. 768 – 770.
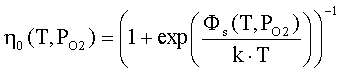
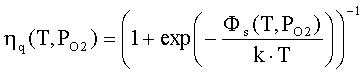
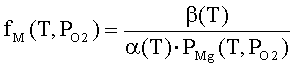
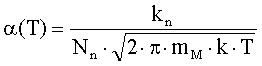
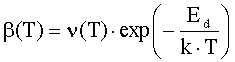
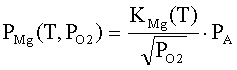 ,
,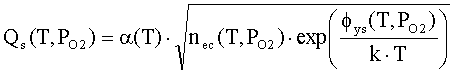
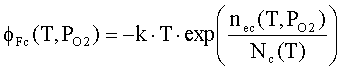
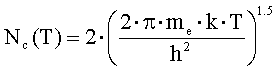
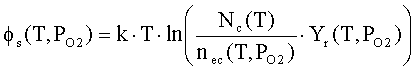
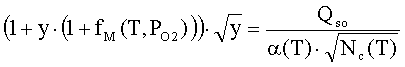
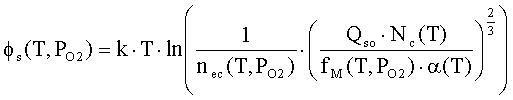
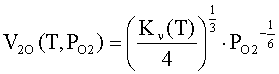 ,
,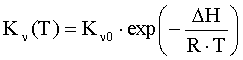 ,
,