Галаган Р. Л., Білий
О. В., Хомич О.П., Біла Л. М. , Бочарнікова В. М.,
Карловська Н. Є., Нелень Т.І., Глазков Є. В.
Черкаський
національний університет імені Богдана Хмельницького
18031,
м. Черкаси, бульвар Шевченка 81
ІНВЕРСІЙНА ХРОНОПОТЕНЦІОМЕТРІЯ З КОНТРОЛЬОВАНИМ
СИНУСОЇДНИМ СТРУМОМ В ДОСЛІДЖЕННІ ВОДНИХ РОЗЧИНІВ ДВОХАТОМНИХ ФЕНОЛІВ,
НІКОТИНОВОЇ КИСЛОТИ ТА НІКОТИНАМІДУ
Наші дослідження водних розчинів двохатомних фенолів та вітаміну В5 (нікотинової кислоти та нікотинаміду) [1–6] показали, що як в електроаналізі, так і для вивчення механізму електродних процесів розчинів органічних речовин можна успішно використовувати ті вольтамперометричні методи, для яких недостатньо виявлені кінетичні закономірності. У даній роботі для дослідження таких розчинів застосували хронопотенціометрію з контрольованим синусоїдним струмом, а саме, варіант “швидкість зміни потенціалу– потенціал (dE/dt–E)”, з використанням, в якості індикаторного, платинового мікроелектрода.
Методика експерименту описана [6]. Удосконалення електричної
схеми полярографічної установки дозволило автоматично встановлювати початковий
потенціал поляризації електрода змінним струмом, що поліпшило відтворюваність
умов поляризації електрода і, відповідно, полярограм. Удосконалення програмного
забезпечення комп’ютерної реєстрації полярограм суттєво розширило інформацію
про параметри полярограм в перші один–три десятки секунд після початку
поляризації електрода, а саме впродовж зміни потенціалу від заданих початкової
величини (Епоч.) та до кінця його розгортки (РП). Або, інакше,
дозволило фіксувати полярограми в динаміці зміни РП.
Одна з особливостей використаного методу полягає в тому, що
через електрод проходить струм, який містить постійну і змінну складові. Тому в
даній роботі спробували вивчити можливість одержання інверсійних полярограм dE/dt–E
для вищезазначених розчинів.
У роботі врахували те, що, при одержанні інверсійних
полярограм для розчинів органічних речовин, процес накоплення можливий для
хімічних сполук, які або здатні помітно адсорбуватись на електроді, або бути
учасниками редокс-реакції з утворенням при цьому відносно стійкого продукту
реакції. Відомо також [7], що ароматичні органічні речовини та ті, що містять
атоми з неподіленими парами електронів, помітно адсорбуються на платиновому електроді.
У більшості електрохімічних досліджень двохатомних фенолів йдеться [8] про пару
хінон–гідрохінон (Х–ГХ). На полірованому електроді ця редокс-реакція оборотна
до тих пір, доки не починає проявлятися інгібірування електродної реакції
хіноноподібними частинками, які утворюються не тільки як продукт окиснення, а й
як продукт взаємодії хінону з фоновим електролітом, наприклад,
галогеноводневими кислотами. У нашій роботі вивчались і розчини пірокатехіну
(ПК) та резорцину (РЦ). Як індикаторний мікроелектрод, застосували платиновий,
як електрод порівняння – насичений арґентхлоридний. Для нікотинової кислоти та
нікотинаміду фоном служив 1 М розчин калій хлориду, для двохатомних
фенолів – 1 М розчин хлоридної кислоти.
Характерні зубці чи западини на одній чи обох сторонах
полярограми можуть вказувати, за положенням їх відносно вісі потенціалів (Е),
як на оборотну чи необоротну редокс-реакцію, так і на адсорбційний процес на
поверхні електрода.
Визначення інтервалу потенціалів адсорбції досліджуваної
речовини базувалось на такій відомій [9] закономірності для полярограм,
одержаних використаним методом, як вихід, у цьому інтервалі потенціалів,
контурів полярограми для розчину речовини за контури полярограми фону. Це
випливає з теорії використаного в роботі методу [10]. Згідно рівняння Ія =Іс +ІФ=Const, де Ія – струм,
що протікає через ячейку, ІФ – фарадеївський струм поява
струму розряду деполяризатора призводить до зменшення ємнісного струму (Іс).
Відповідно зменшується dE/dt. Зменшення проявляється у появі зубців на
полярограмі dE/dt–Е.
В області потенціалів, при яких речовина адсорбована на електроді, ємність (С)
подвійного електричного шару зменшується,
а похідна dE/dt збільшується, бо, якщо ІФ відсутній, то Ія =Іс=С·dE/dt=Const.
Тому контури полярограм dE/dt–Е
для розчину речовини виходять за межі контурів полярограми фону. У даній роботі
показано, що адекватна закономірність спостерігається і при зівставленні
полярограм фону та інверсійних полярограм для розчинів нікотинової кислоти та
нікотинаміду на фоні 1 М розчину калій хлориду (рис. 1).
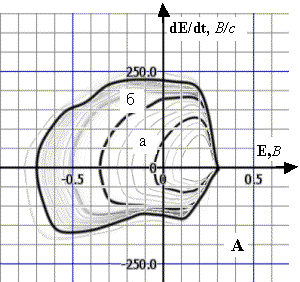
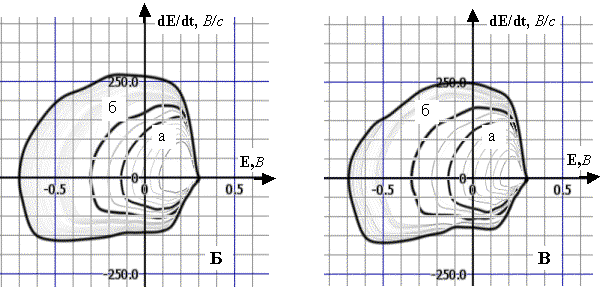
Рис. 1. Динаміка
полярограм dE/dt–E 1 М розчину КС1 (А),
5·10–4 М розчину НКА (Б) та 5·10–6 М
розчину НКА (В) у межах заданої РП (фон – 1 М розчин КС1, початкова
катодна поляризація, Епоч.=0,3 В, РП=1,0 В):
А. а) РП=0,35 В; б) РП=0,65 В;
Б. а) РП=0,43 В; б) РП=0,60 В;
В. а) РП=0,44 В; б) РП=0,64 В;
Енакопл.=0,1 В, tнакопл.=5 хв
Вважали, що, при одержанні інверсійних полярограм,
потенціал накоплення має знаходитися у межах попередньо визначеного інтервалу
потенціалів адсорбції, а оптимальною величиною є потенціал найбільшої різниці у
величині анодної чи катодної частин полярограми досліджуваного розчину та фону
відносно вісі dE/dt (D1max,a, D1max,к).
Оптимальною величиною потенціала накоплення для розчину редокс-систем,
якими і в даному дослідженні проявились ГХ та ПК, є той, після якого має місце
зменшення зростання dE/dt. Таким підходом скористались і для РЦ. Щоб
врахувати можливий вплив на інверсійні полярограми досліджуваних розчинів
домішок у фоновому електроліті, одержували і для розчину фону так звані
“холості” інверсійні полярограми.
Концентрацію розчину речовини, для якого передбачалося
одержання інверсійної полярограми, обирали так, щоб його полярограма не відрізнялася
від полярограми фону. Накоплювали досліджувану речовину на електроді за умов
поляризації його постійним струмом, а слідом за цим процесом одержували
полярограми dE/dt–E.
Оптимальний потенціал накоплення речовини визначали, накладаючи одна на одну
полярограми для фону і розчину з більш високою концентрацією досліджуваної
речовини на цьому фоні, які одержували за однакових умов поляризації електрода
змінним струмом. Умови поляризації електрода, концентрація такого розчину
підібрані так, щоб одержана полярограма була характерною, тобто помітно
відрізнялась від такої для фону, і стабільною. При цьому варіювали не лише
величинами початкового потенціала (Епоч.) та розгортки потенціала
поляризації електрода, а й застосовували різні напрями початкової поляризації
електрода (або у бік більш позитивних значень потенціалу, або у бік більш
негативних значень), дотримуючись, у такому разі, однакової його розгортки
(1,0 В). На рисунках 2–5 зіставлені полярограми для ГХ та ПК на фоні
1 М розчину хлоридної кислоти, з яких видно, що ГХ на інверсійних
полярограмах може проявитись як характерним зубцем на анодній стороні
полярограми, так і у вигляді D1max,a, а ПК – тільки як D1max,a або D1max,к . Для розчину РЦ, електрохімія
якого найменше вивчена, інверсійні полярограми помітніше відрізняються від
полярограми фону, ніж звичайні (рис. 2, 6).
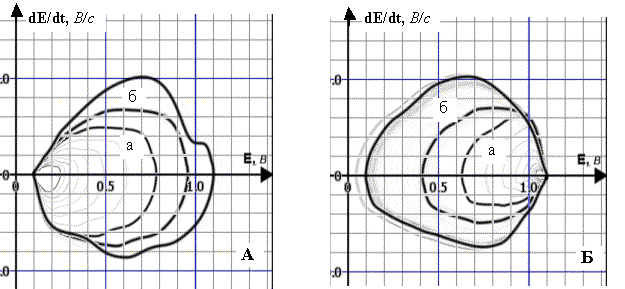
Рис. 2. Динаміка
полярограм dE/dt–E 1 М розчину хлоридної кислоти
у межах заданої РП (1,0 В):
А. а) РП=0,68
В; б) РП=0,86 В; початкова анодна поляризація, Епоч.=0,1 В;
Б. а) РП=0,40
В; б) РП=0,65 В; початкова катодна поляризація, Епоч. = 1,1 В.
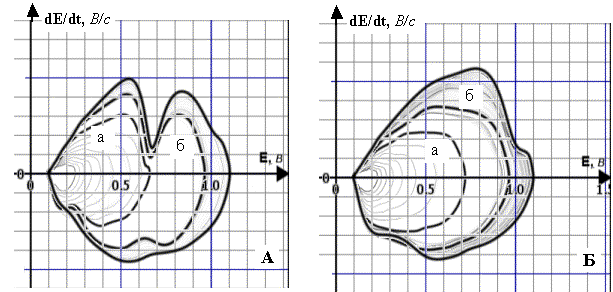
Рис. 3. Динаміка полярограм dE/dt–E 4·10–3 М розчину ГХ (А) та 10–5 М
розчину ГХ (Б) у межах заданої РП (фон – 1 М розчин НС1, початкова анодна
поляризація, Епоч.=0,1 В,
РП=1,0 В):
А. а) РП=0,56 В; б) РП=0,87 В;
Б. а) РП=0,62 В; б) РП=0,86 В;
Енакопл.=0,55 В, tнакопл.=5 хв
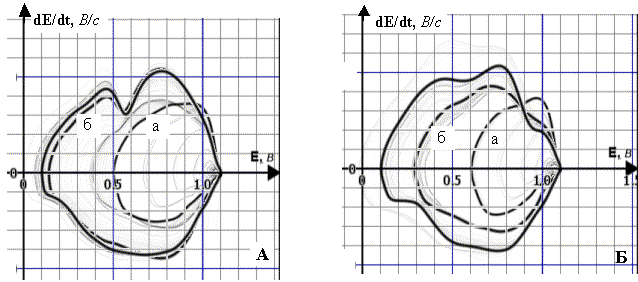
Рис. 4. Динаміка полярограм dE/dt–E 4·10–3 М
розчину ГХ (А) та 10–5 М розчину ГХ (Б) у межах заданої РП (фон
– 1 М розчин НС1, початкова катодна поляризація, Епоч.=1,1 В, РП=1,0 В):
А. а) РП=0,36 В; б) РП=0,89 В;
Б. а) РП=0,49 В; б) РП=0,80 В;
Енакопл.=0,50 В, tнакопл.=5 хв
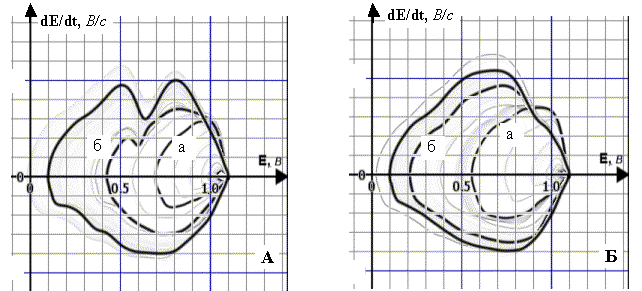
Рис. 5. Динаміка полярограм dE/dt–E 4·10–3 М
розчину ПК (А) та 10–5 М розчину ПК (Б) у межах
заданої РП (фон – 1 М розчин НС1, початкова катодна поляризація, Епоч.=1,1 В, РП=1,0 В):
А. а) РП=0,40 В; б) РП=0,67 В;
Б. а) РП=0,58 В; б) РП=0,88 В; Енакопл.=0, 50 В, tнакопл.=5 хв
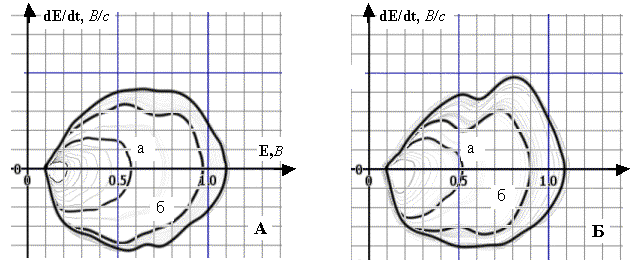
Рис. 6. Динаміка полярограм dE/dt–E 8·10–3 М
розчину РЦ (А) та 10–4 М розчину РЦ (Б) у межах заданої РП (фон
– 1 М розчин НС1, початкова анодна поляризація, Епоч.=0,1 В, РП=1,0 В):
А. а) РП=0,47 В; б) РП=0,87 В;
Б. а) РП=0,42 В; б) РП=0,80 В; Енакопл.=0,1 В, tнакопл.=5 хв
Отже, хронопотенціометрію з контрольованим змінним струмом
на платиновому мікроелектроді можна успішно застосовувати для визначення
низьких концентрацій органічних речовин в розчинах, а динамічні полярограми –
не менш успішно використовувати при вивчені механізму електродних
редокс-реакцій.
Література
1. Біла
Л.М., Галаган Р.Л., Карловська Н.Є., Білий О.В. Дослідження
електрохімічної поведінки гідрохінону методом осцилополярографії з заданим
змінним струмом у водних розчинах. // Вісник Черкаського університету. Серія
хімічні науки. – 2002. – С. 32-37.
2. Білий
О.В., Карловська Н.Є., Біла Л.М., Бочарнікова В.М., Галаган Р.Л., Лут
О.А., Нелень Т.І., Хомич О.П. Дослідження електрохімічної поведінки
гідрохінону методом полярографії з заданим синусоїдним змінним струмом.
Матеріали Першої Міжнародної науково-практичної конференції “Науковий потенціал
світи 2004”. – Т. 26. – Хімія та хімічні технології. – Дніпропетровськ:
Наука і освіта. – 2004. – С. 3.
3. Белый О.В., Галаган Р.Л., Лут Е.А., БочарниковаВ.Н.
Применение полярографии с заданным синусоидальным током для количественного
определения гидрохинона. // Материалы научно-практической конференции
«Перспективные разработки науки и техники». Т.9. – Белгород. – 2004.
–С. 3-7.
4. Білий О.,
Галаган Р., Лут О., Біла Л., Нелень Т., Карловська Н.,
Бочарнікова В. Застосування полярографії з заданим змінним струмом для
дослідження водних розчинів системи хінон–гідрохінон. // Збірник наукових
праць. Десята нукова конференція “Львівські наукові читання–2005”. – Львів. –
2005. – С. Ф. 82.
5. Р.Л. Галаган,
О.П. Хомич, Л.М. Біла, О.А. Лут, В.М. Бочарнікова,
Н.Є. Карловська, Т.І. Нелень, О.В. Білий. Дослідження водних
розчинів нікотинрової кислоти та нікотинаміду методом хронопотенціометрії з
контрольованим змінним струмом. // Наукові записки. Серія хімія. –Тернополь. –
2008. – Вип. 13. – С. 38-46.
6. Галаган
Р.Л., Хоміч О.П., Біла Л.М., Лут О.А., Бочарнікова В.М., Карловська Н.Є.,
Нелень Т.І., Білий О.В. Дослідження водних розчинів Нікотинової кислоти і
нікотинаміду методом хронопотенціометрії з заданим змінним струмом // Збірник
праць конференції “Научная индустрия европейского контитнента”. –
Днепропетровск. – 2007. – С. 33-38.
7. Электрохимия органических соединений / Под. ред.
А.П. Томилова, Л.Г. Феоктистова. – М.: Мир, 1976. – С. 6-17.
8. Оразбекава Н.К., Кулиев С.А.,
Сейтжанов А.Ф., Фасман А.Б., Васильев Ю.Б. Адсорбция гидрохинона
на гладком платиновом электроде // Электрохимия. – 1992. Т. 28. –
С. 849
9. Гороховская В.И.,
Гороховский В.М. Практикум по осцилографической полярографии. – М.: Высшая школа, 1973. – С. 94-101.
10. Делимарский Ю.К., Скобец Е.М.
Полярография на твердых электродах. – К.: Техніка,
1970. – С. 122-151.