Яремкевич О., Бура М.1, Кулачковський О.1, Лубенець В.,
Санагурський Д.1,
Новіков В.
Національний
університет «Львівська політехніка», кафедра технології
біологічно активних
сполук, фармації та біотехнології;
1Львівський національний університет імені Івана Франка, кафедра
біофізики
та біоінформатики;
Вплив толуентіосульфонату калію на мембранний потенціал та мембранозалежні
процеси зародків в’юна
Дослідження останніх років показали велику зацікавленість
до створення синтетичних аналогів природних біорегуляторів, які поєднують у
собі декілька фармакофорів та є одним з перспективних напрямків у створені
лікарських препаратів [Filimonov D., 1999]. Синтезовані тіосульфонати є близькими аналогами
природного антибіотику аліцину. Ароматичні
тіосульфонати є ефективними інгібіторами агрегації тромбоцитів, що є
підґрунтям для створення на їхній основі нових антитромботичних препаратів [MacDonald J., 2004]. Відомі
тіосульфоестери, які проявляють антималярійну та антивірусну дію [Frankenberg L., 1980]. Зокрема, гетероциклічні
тіосульфонати, що містять кільця індолу, індоліну, бензоімідазолу і
хіноксаліну, отримані науковцями з Мічегану, проявили високу ВІЛ-протеазну
активність [ Prasad V. N. V., 2000].
Виходячи з
вищевказаного, подальше дослідження тіосульфонатів є актуальним та
перспективним, оскільки це дасть можливість поглибленого розуміння механізмів
біологічної дії цих речовин та покращення їх лікувальних властивостей.
У результаті проведених досліджень виявлено, що під час неперервної
реєстрації ТМП зародків, інкубованих в середовищі з додаванням досліджуваної
речовини, спостерігаються аперіодичні зміни його рівня (рис. 1, крива 1). При
порівнянні двох кривих, можна помітити, що періоди першого (2 бластомери) та
третього (8 бластомерів) поділів становили 20 хв й за тривалістю не співпадали
з мітотичними циклами синхронних поділів бластомерів, як це спостерігали у
контролі (рис. 1, крива 2).
Другий, четвертий, п’ятий та шостий клітинні поділи навпаки характеризувалися
збільшенням тривалості періоду до 42, 39, 45 та 55 хв відповідно. Спостерігаємо також зменшення амплітуди у кожному
періоді в середньому на 8÷12
мВ та зменшення наростання максимальних значень коливань МП на 40 мВ у
порівнянні з контролем. Такі результати показують про часткові порушення
електрогенезу клітинних мембран за умов впливу даної речовини та свідчать про
зміни проникливості плазматичної мембрани і транспорту іонів, котрі можуть
міняти активність ряду ферментів, в тому числі Na+, К+-АТФази,
а значить і енергозабезпечення систем клітини, й, як наслідок, транслокацію
катіонів, що й приводить до зниження рівня ТМП.
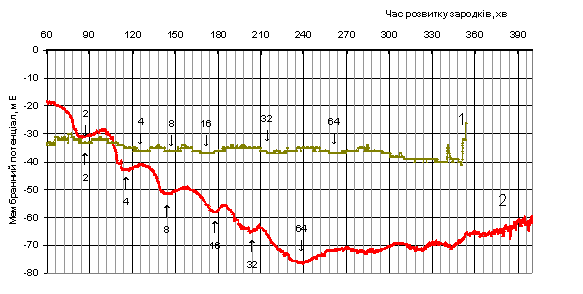
Рис. 1. Вплив
толуентіосульфонату калію (в
концентрації 4·10-5М)
(1) на ТМП в ранньому розвитку зародків в’юна у порівнянні з контролем (2)
Зменшення ТМП
відбувається як завдяки збільшення іонної проникливості мембрани, так і при
вирівнюванні концентрацій іонів внаслідок виключення роботи клітинних помп при
прямій дії на Na+, К+–АТФазу або при зниженні рівня АТФ
внаслідок порушення біоенегетичних процесів у мітохондріях, що і доводять нам
результати ультраструктурних досліджень, де спостерігаються зміни
субмікроскопічних структур, котрі приймають участь у синтезі білка – змінюється
кількість, розміщення та електронна щільність рибосом, відбувається деструкція
мітохондрій, що викликає порушення внутрішньоклітинної біоенергетики. Проте,
виходячи з цих даних неможливо зробити висновок про спрямованість та
інтенсивність білкового синтезу.
|
|
|
|||
|
|
|
|||
|
в |
г |
|||
|
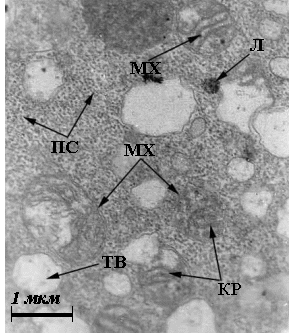
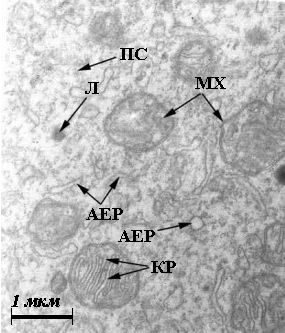
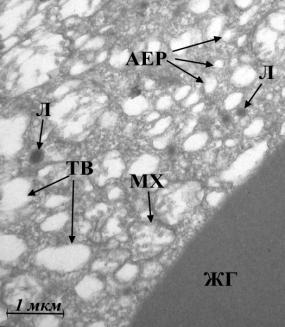
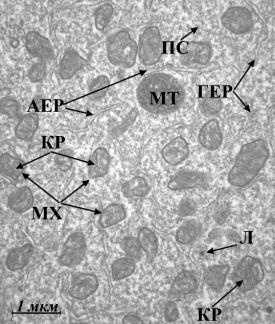
Рис. 4. Ультраструктура
бластомерів зародків в’юна на стадії 2 бластомерів за нормальних умов (а, б)
та за умов дії толуентіосульфонату калію у концентрації 4·10-3
М (в), у концентрації 4·10-9
М (г): АЕР – агранулярний ЕПР; ГЕР – гранулярний ЕПР; ЖГ – жовткові гранули;
КГ – комплекс Гольджі; КР – кристи мітохондрій; Л – лізосоми; М– моносоми; МТ
– мультивезикулярні тільця; МХ – мітохондрії; ПС – полісоми; ТВ – травні
вакуолі.
(Електронна мікрофотографія x10 000). |
||||
Для детальнішого розуміння механізмів дії досліджуваної речовини нами
проведені дослідження in vivo впливу
толуентісульфонат калію у концентраціях 4·10-3М
та 4·10-9М на активність
мембранного ферменту Na+, К+–АТФази зародків
упродовж стадій синхронного поділу
бластомерів.
У результаті
проведених досліджень можна зробити висновок, що дія тіосульфонатів веде до
достовірних дозозалежних змін активності мембранозв’язаного ферменту зародків:
найбільш інгібувальний вплив виявлено за наявності в середовищі інкубації
біологічно активної речовин у концентрації 4·10-3 М, тоді як
внесення у середовище тіосульфонатів низьких концентрацій (4·10-9 М)
веде до підвищення активності Na+, К+–АТФази зародків у
порівнянні з контролем (рис. 2). Очевидно у низьких концентраціях ці біологічно
активні речовини або їх первинні метаболіти здатні включатися у метаболічні
процеси зародків та призводити до підвищення інтенсивності обміниих
процесів у зародків.
|
|
|||
|
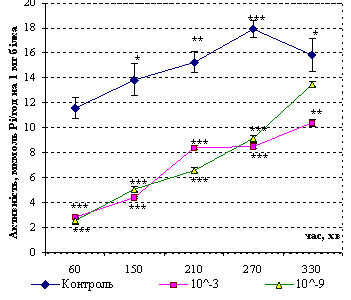
Рис. 2.
Зміни активності Na+, K+-АТФази зародків за умов впливу
толуентіосульфонату калію (4·10-3
М, 4·10-9М ) упродовж синхронних поділів
бластомерів в порівнянні з контролем. Вірогідні зміни порівняно із контролем: *
– р <0,05; ** – р
<0,01; *** – р <0,001. |
З
огляду на вищезазначене, можна стверджувати, що тіосульфонати є
цікавими та перспективними речовинами для створення лікарських препаратів та пошук серед них антимітотичних і
антипроліферативних засобів знайде широке застосовуються в хіміотерапії
онкологічних захворювань та при лікуванні аутоімунних паталогій.
(Робота
виконана за підтримки Державного фонду фундаментальних досліджень, проект
№Ф.25.5/075)