К.т.н. Науменко О.В.
Інститут продовольчих ресурсів
НААН України, Україна
Поширення бактеріофагів на молочних заводах України
Бактеріофаги
лактобактерій є основним біологічним фактором, що спричинює різноманітні вади
ферментації молока. На виробництвах, де зосереджена велика маса бактеріальної
культури в експоненціальній фазі росту, створюються сприятливі умови для розмноження
бактеріофагів. Заквашувальні культури постійно інфікуються вірусами, які
містяться у сирому молоці, де їх кількість може сягати від 101
до 104 БУО/см3 [1]. За оцінкою іспанських вчених,
принаймні 10% зразків молока на молокопереробних підприємствах містять
бактеріофаги [2]. Завдяки своїм мікроскопічним розмірам бактеріофаги також здатні
до аерозольного поширення. За деякими дослідженнями встановлено, що у 1 м3
повітря на молочному підприємстві може міститися до 103
фагових часток [3]. Значну роль у розповсюдженні фагів відіграють їх
властивості: висока мутаційна мінливість, термостійкість, здатність тривалий час
зберігати свою інфекційність тощо [4]. Внаслідок інфікування заквашувальних
культур бактеріофагами знижується ферментативна активність штамів, погіршується
якість готової продукції. Крім того може відбуватися вторинна контамінація
молочних виробів сторонньою мікрофлорою. Очевидно, що все це призводить до
значних матеріальних втрат на виробництві, що спонукає вчених усього світу
шукати можливі способи вирішення даної проблеми.
На сьогодні
універсальних методів боротьби з фаголізисом не існує. Всі запропоновані заходи
лише частково обмежують розмноження бактеріофагів або дозволяють виявити їх наявність
у культурі на ранніх етапах ферментації молока. Найбільш дієвим способом є
використання фагостійких штамів мікроорганізмів, селекція та конструювання яких
відбувається постійно. Для відбору фагорезистентних культур ряд країн
систематично здійснює фаговий моніторинг на підприємствах молочної
промисловості [5].
Тому для з’ясування фагової ситуації було проведено
фаговий моніторинг продукції ряду
молокопереробних і сироробних заводів України. Природними
джерелами накопичення та виділення фагів були наступні об’єкти: сире та
пастеризоване молоко, сироватка, різноманітні молочні ферментовані продукти,
сири, змиви з обладнання, закваски.
Встановлено, що біля 70% обстежених
зразків містили фаги лактобактерій в тому чи іншому титрі: I низький рівень – від 1 до 101 БУО/см3; II середній
рівень – від 102 до 104 БУО/см3 та III високий рівень – від 105 і більше БУО/см3 .
Найбільшу
контамінованість фагами виявлено під час моніторингу виробництва сирів, як
твердих сичужних так і кисломолочних - наявність фагів у 94% досліджених
зразків. Ступінь фагового забруднення сирів був традиційно високим для
вітчизняної промисловості - II - III рівні.
Встановлено,
що на молочних підприємствах із
збільшенням асортименту продуктів значно розширився спектр фагів, які здатні
згубно впливати на молочнокислі бактерії різних таксономічних груп. До того ж ступінь забруднення фагами зростав із збільшенням
видового спектру заквашувальних культур, які застосовувались для виробництва
того чи іншого виду продуктів (рис.1).
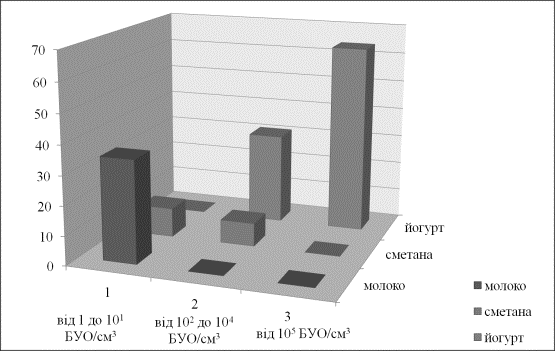

Рис.1 - Рівні фагового забруднення
Встановлено, що фагові ізоляти розрізняються за літичною активністю щодо різних видів культур і
утворюють 5 груп. Більшість виділених фагів
були видоспецифічними щодо мезофільних лактобактерій Lactococcus lactis. За оцінками експертів
2/3 всіх процесів ферментації здійснюється молочнокислими бактеріями виду L. lactis. Відповідно, фаги, вірулентні
по відношенню до даних бактерій є найбільш поширеними на молокопереробних
підприємствах України та світу, а тому потребують найбільш детального вивчення
[5].
Крім того було виділено фаги, що лізують Streptococcus thermophilus. Структурні та
морфологічні особливості досліджуваних бактеріофагів визначали методом
трансмісійної електронної мікроскопії. Було встановлено, що фаги мали довгі нескоротливі
хвостові відростки, тому їх було віднесено до порядку Caudovirales, родини Siphoviridae. Фаги L. lactis вирізнялись
за формою головки: виявлено фаги з ікосаендричними головками морфотипу В1 і
фаги з пролатними головками морфотипу В2 (рис. 2).
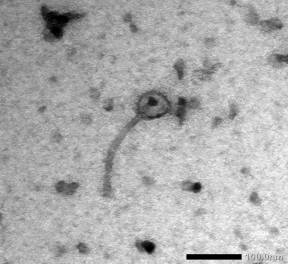
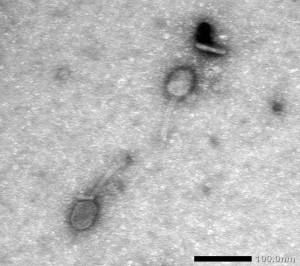
А Б
Рис. 2 - Електронограма вірусів L. lactis різних морфотипів:
А - Фаг F 8 морфотип В1 (ікосаендрична головка,
відсутність комірця)
Б - Фаг F 10 морфотип В2 (пролатна
видовжена головка, відсутність комірця)
Фаги
S. thermоphilus були морфологічно подібними між собою і належали до родини Siphoviridae,
морфотипу В1: мали маленьку ізометричну головку та довгий нескоротливий
хвостовий відросток (рис. 3).
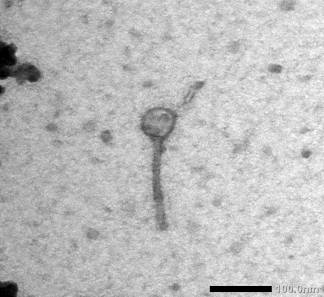
Рис. 3 - Електронограма фага S. thermоphilus Ф7, морфотип В1
Було встановлено
оптимальні умови репродукції різних бактеріофагів: відібрано індикаторні
культури - нелізогенні та високочутливі до конкретних видів фагів (штами, вік
культури), поживні середовища (склад, рН), множинність інфекції, умови довгострокового зберігання фагів.
Для
кожного з виділених фагів було визначено індекс літичної активності, як
співвідношення фагочутливих культур до загальної кількості тестованих культур з
колекції відділу біотехнології ІПР. Значення індексу літичної активності
становило 0,15-0,33 залежно від фагу. Згідно з літературними даними, такі величини
індексів є доволі високими, до того ж широка географія розповсюдження та
значний відсоток технологічних відхилень, спричинених цими бактеріофагами,
свідчать про те, що вони представляють собою велику загрозу для молочної галузі
України.
Як відомо, активність фаголізису залежить від особливостей життєвого циклу
вірусу [6]. Встановлено параметри літичного циклу досліджуваних
вірусів, а саме: ефективність адсорбції, тривалість латентного періоду та вихід
фагу (табл. 1).
Таблиця 1- Характеристика
літичного циклу бактеріофагів
|
Фаг |
Індикаторна культура |
Ефективністьадсорбції,
% |
Тривалість латентного
періоду, хв |
Вихід фага |
|
Ф1 |
4 dl |
92 |
20-30 |
112 |
|
Ф2 |
л1/1 |
72 |
30-40 |
86 |
|
Ф3 |
S/12 |
91 |
30-40 |
78 |
|
Ф4 |
2 dl |
92 |
20-30 |
51 |
|
Ф5 |
L.l 4 |
89 |
20-30 |
36 |
|
Ф6 |
Cr 63 |
81 |
20-30 |
118 |
|
Ф7 |
S/27 |
51 |
30-40 |
87 |
|
Ф8 |
L.2 |
84 |
20-30 |
73 |
|
Ф9 |
л3/10 |
97 |
20-30 |
97 |
|
Ф10 |
Cr 9 |
71 |
30-40 |
43 |
Визначено, що ефективність адсорбції вірусів варіювала
в межах від 51 до 97%. Проміжок часу від моменту
входження вірусу в клітину до її лізису також варіював серед досліджуваних
бактеріофагів - латентний період тривав (20-40) хв для різних
ізолятів. Показано,
що кількість вірусних часток, що виходять з однієї клітини може становити від
36 до 118 віріонів. Найбільшою інфекційністю характеризувались фаги
з коротким латентним періодом та високим виходом фагів.
Ці
показники свідчать про високу потенційну небезпечність досліджуваних фагів.
Оскільки за літературними даними, тривалість латентного періоду лактофагів знаходиться в
межах від 20 до 60 хв (за 30°С), а вихід
фагових часток становить від 34 до 328 [7].
Безсумнівно розробка нових ефективних методів для боротьби з фаголізисом
потребує всебічного вивчення біологічних властивостей фагів. Подібні
дослідження окрім практичної, мають і наукову цінність, оскільки дозволяють
розширити наші знання щодо різноманітності бактеріофагів та особливостей їх
життєвого циклу.
Моніторинг
та вивчення властивостей фагів, активних щодо промислових культур лактобактерій,
сприятимуть розробці заходів, спрямованих на профілактику ситуацій фаголізису
на виробництві, а також створенню ефективних програм селекції фагостійких
штамів заквашувальних культур і їх ротації.
Література:
1.
Garneau J. Bacteriophages of lactic acid bacteria and their impact on
milk fermentations / J.
Garneau, Moineau S. // Microbial Cell Factories. – 2011. – Vol. 10, № 2. – P. 1-10.
2. Biodiversity and
Classification of Lactococcal Phages / H. Deveau, S. Labrie, M.-С. Chopin, S. Moineau
// Applied and Environmental Microbiology. – 2006. – Vol. 72, № 6. – P.
4338–4346.
3.
Detection of Airborne Lactococcal Bacteriophages in Cheese Manufacturing
Plants / D. Verreault, L. Gendron,
M. Rousseau, M. Veillette, D. Massé, G. Lindsley, S. Moineau, C.
Duchaine // Applied and
Environmenal Microbiology. – 2011. – Vol. 77, № 2. – Р. 491–497.
4.
Biodiversity of Lactococcus lactis bacteriophages in Polish dairy
environment / A. Szczepańska, M. S. Hejnowicz, P. Kołakowski, J.
Bardowski // Acta Biohimica
Polonica. – 2007. – Vol. 54, № 1. – Р. 151–158.
5.
Raiski A. Biodiversity of Lactococcus
lactis bacteriophages in the Republic of Belarus / A. Raiski, N. Belyasova
// International Journal of Food Microbiology. – 2009. – Vol. 130, № 1. – P.1-5.
6.
Bacteriophages in milk fermentations: Diversity fluctuations of normal and
failed fermentations / H. P. Kleppen, T. Bang, I. Nes, H. Holo // International
Dairy Journal. – 2011. – Vol. 21, № 1. – Р. 592-600.
7.
Гудков А. В. Сыроделие:технологические, биологические и физико-химические
аспекты / А.
В. Гудков. – Москва: Дели принт, 2004. –
250 с.