Биологические науки/ 6. Микробиология
К.т.н. Даниленко С.Г.1,
К.т.н Король Ц.О.1,
Студент Коваленко Л.М.2
1Інститут продовольчих
ресурсів, м. Київ, Україна
2Національний університет харчових технологій, м. Київ, Україна
Опрацювання
складу поживного середовища для
нагромадження біомаси заквашувальної композиції “ЛРР”
На попередніх етапах роботи було створено заквашувальну композицію “ЛРР” до складу якої входять культури видів Lactobacillus rhamnosus та Kocuria rosea.
Оскільки лакто-
(МКБ) і мікрококи (МК) характеризуються різними вимогами до джерел живлення і
енергії, для здійснення їх спільного культивування необхідно підібрати такий
склад середовища, що буде оптимальним для розвитку кожного з мікробних
компонентів.
Метою даної
роботи було опрацювати склад поживного середовища для нагромадження
біомаси заквашувальної композиції “ЛРР”
Об’єктами
дослідження були штами молочнокислих бактерій Lасtobacillus rhamnosus, та Kocuria rosea з колекції
промислових штамів відділу біотехнології Інституту продовольчих ресурсів НААН.
У роботі використовували традиційні та сучасні
мікробіологічні методи дослідження. Активну і титровну кислотність визначали
згідно з ГОСТ 3624-92. Інтенсивність розвитку заквашувальної культури у поживних
середовищах оцінювали за динамікою нагромадження клітин, оптичною густиною та
зміною активної кислотності. Кількість молочнокислих бактерій визначали в 1 см3–
згідно з ГОСТ 10444.11-89, кількість життєздатних клітин мікрококу – шляхом
висіву відповідних серійних розведень у стерильному фізіологічному розчині на
м’ясо-пептонний агар з 5 % NaCl.
Було
досліджено 3 варіанти поживних середовищ
(ПС), як
контроль (К) було обрано середовище на основі м’ясопептонного бульйону з
додаванням глюкози. Слід зауважити, що промислове використання цього середовища
є економічно невиправданим через високу вартість компонентів, тому необхідно
було розробити напівсинтетичні поживні середовища, прийнятні для промислового
застосування.
Поживні середовища готували на воді з додаванням компонентів, які необхідні для розвитку бактерій – джерел вуглецю, азоту, мікроелементи. Було розроблено три варіанти поживних середовищ (табл. 1), які розрізнялись між собою як за джерелом, так і кількістю азотного та вуглецевого компонентів.
Таблиця
1
Склад поживних середовищ
|
Компоненти |
Варіанти середовищ |
|||
|
К |
1 |
2 |
3 |
|
|
CЗМ,
г |
- |
- |
- |
10 |
|
Вода, дм3 |
- |
1 |
1 |
1 |
|
Цитрат натрію, г |
- |
10 |
10 |
10 |
|
Ацетат натрію, г |
-* |
5 |
5 |
5 |
|
MgSO4, г |
- |
0,5 |
0,5 |
0,2 |
|
MnSO4, г |
- |
0,1 |
0,1 |
0,5 |
|
Твін-80, см3 |
- |
1 |
1 |
1 |
|
NaCl, г |
5 |
5 |
5 |
5 |
|
FeSO4·7H2O, мг |
- |
10 |
10 |
10 |
|
Пептон, г |
10 |
10 |
5 |
10 |
|
М’ясна вода, см3 (Поживний бульйон, г) |
1000 (17) |
- |
150 (6) |
- |
|
Дріжджовий автолізат, см3 |
- |
- |
20 |
20 |
|
Аскорбінова кислота, мг |
- |
100 |
- |
500 |
|
В12, мг |
- |
- |
0,05 |
- |
|
Глюкоза, г |
20 |
20 |
10 |
10 |
|
Лактоза, г |
- |
- |
10 |
10 |
|
К2НРО4, г |
- |
1,0 |
1,0 |
2,0 |
|
NH4H2PO4, г |
- |
1,0 |
1,0 |
- |
|
рН до стерилізації |
7,2 |
7,4 |
7,4 |
8,0 |
Примітка *. (-) компонент середовища відсутній.
Основу цих середовищ склали цитриновий та оцтовокислий натрій, мінеральні солі Mg і Mn, Твін-80, NaCl та пептон. Поживне середовище № 1 готували на вищеозначеній основі з додаванням аскорбінової кислоти, сульфату заліза, фосфатів Як С-джерело використовували глюкозу, тоді як до складу середовища № 2 та № 3 вносили глюкозу та лактозу, у співвідношенні (1:1). Додатково до ПС 2 залучали сульфат заліза, вітамін В12 та поживний бульйон, або м’ясну воду. Це дозволило зменшити вміст пептону вдвічі,. До основи середовища № 3 додавали, сухе знежирене молоко (СЗМ), дріжджовий автолізат (ДА) як джерело амінокислот та вітамінів та збільшували у п‘ять разів кількість аскорбінової кислоти.
Оскільки
композиція «ЛРР» складається із мезофільних лактобацил та термофільного
мікрококу, тому для культивування було обрано температуру (32±1) ºС. Композицію
вирощували у періодичному режимі впродовж 18 год. Інтенсивність розвитку її оцінювали
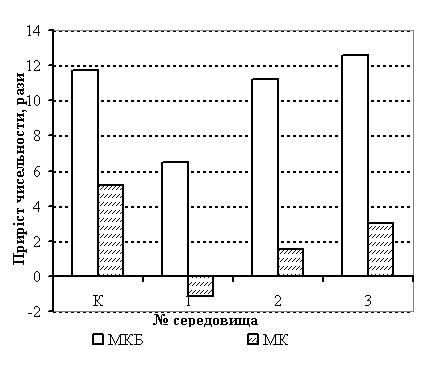
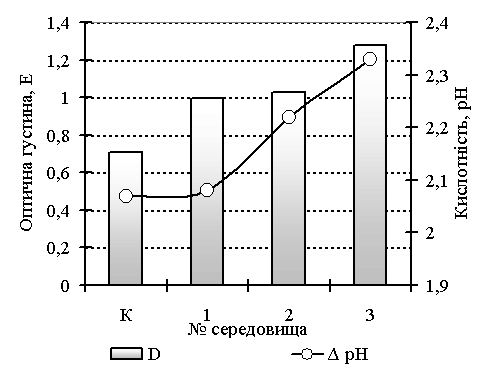
за оптичною густиною, рівнем рН та чисельністю клітин, (рис. 1).
а
б
МКБ – молочнокислі бактерії, МК- мікрокок, 1, 2, 3, К –
варіанти поживних середовищ, D – оптична густина.
Рис. 1. Розвиток композиції «ЛРР» на різних ПС. Чисельність бактерій(а)
та зміна оптичної густини, та кислотності (б)
Було
встановлено, що у середовищі № 1 розвиток молочнокислих бактерій композиції
“ЛРР” був повільним і за весь термін культивування популяція їх зросла лише в
5,4 разів порівняно з контролем (К), тоді як для мікрококів це середовище було
взагалі неприйнятним (рис.1 а).
Залучення до середовищ
№ 2 та № 3 поживного бульйону, ДА, вітаміну В12 та СЗМ дало
очікувану інтенсифікацію розвитку МКБ та мікрококів (МК): їхня концентрація
збільшилась у 11,2-20,9 разів та у 1,3-3,0 рази відповідно.
Ці дані
підтверджуються результатами вимірювання оптичної густини культуральної рідини,
яка також зростала інтенсивніше у поживних середовищах (ПС) № 2 - 3 у (1,5
-1,8) рази по відношенню до контролю. Іншим показником розвитку бактерій слугує
рН культуральної рідини. Встановлено, що у дослідних варіантах ПС кислотність
культуральної рідини знижувалась на
2,2-2,3 од. рН (рис. 1 б).
Найкращі
показники приросту чисельності композиції “ЛРР” було отримано у варіантах середовищ
№ 2, № 3, зокрема, урожайність молочнокислих бактерій досягала
(1,1-2,1)∙109 КУО/см3, а мікрококів -
(1,0-1,73)∙107 КУО/см3. ПС № 3 краще задовольняло
харчові та енергетичні потреби мікрококів, ніж молочнокислих бактерій порівняно
з ПС2
Отже, враховуючи
отримані результати було надано перевагу ПС 2 яке відібрано для промислового нагромадження біомаси бактеріальної композиції
“ЛРР”.
Досліджено
динаміку розвитку композиції на різних поживних середовищах. Встановлено, що залучення
до рецептури середовища 5 г пептону, 6 г поживного бульйону, 20 см3 дріжджового
автолізату, 0,05 мг В12, 1,0 г К2НРО4, 1,0 г NH4H2PO4, забезпечує
потреби кожного із складників композиції та їх узгоджений розвиток.