Биологические науки/3. Микология и
альгология
Павличенко
А.К.1, Пасик Ю.С.2, Курченко И.Н.1, Харкевич Е.С.1, Юрьева Е.М.1, Омельчук Е.А.2, Сырчин С.А.1
1Институт микробиологии и вирусологии им. Д.К.
Заболотного НАН Украины, г. Киев, Украина
2Национальный университет пищевых технологий, г.
Киев, Украина
Некоторые
особенности ИНДУКЦИи СИНТЕЗА КОМПОНЕНТОВ ЦЕЛЛЮЛАЗНОГО КОМПЛЕКСА Fusarium sp.
Исследования в области получения целлюлаз с высокой
активностью по отношению к лигноцеллюлозной биомассе продолжают оставаться
актуальными, поскольку позволяют получать сахара для производства биоэтанола
второго поколения, или целлюлозного этанола.
Целлюлазный комплекс представляет собой систему
ферментов, действующих комплексно на целлюлозный субстрат и проявляющих
синергизм действия. В комплекс входят: 1,4-β-D-глюканглюканогидролаза или
эндоглюканаза (КФ 3.2.1.4), 1,4-β-D-глюканцеллобиогидролаза (экзоглюканаза
или целлобиогидролаза КФ 3.2.2.91), β-глюкозидаза (β-D-глюкозидглюкогидролаза
КФ 3.2.1.21) [2].
Целлюлазы имеют большой
биотехнологический потенциал и составляют около 30% мировой продукции
ферментов.
В отделе физиологии и
систематики микромицетов был проведен многоступенчатый скрининг
микроскопических грибов, способных к активному синтезу различных
гидролитических ферментов, в частности целлюлаз. В результате были отобраны ряд
активных штаммов среди которых мезофильный штамм Fusarium sp. обладал
высоким уровнем эндоглюконазной активности.
Материалы
и методы. Объектом исследования был микромицет Fusarium sp., способный к образованию внеклеточных
ферментов целлюлолитического комплекса.
Культивирование
гриба осуществляли глубинным способом на среде, содержащей фильтровальную
бумагу в качестве единственного источника углерода (г/л): бумага – 5, NaNO3 – 2, KH2PO4– 1, KCl –
0,5, MgSO4 –
0,5, FeSO4 –
0,01; при температуре 24˚С в течение 8 суток. Отбор культуральной жидкости
проводили ежедневно.
Эндоглюканазную
активность определяли вискозиметрически по снижению вязкости 0,5% раствора Na-КМЦ
при температуре 50˚С после 10 мин инкубирования с 1 мл культуральной
жидкости. Активность вычисляли по методу [4] с учетом рекомендаций [3].
Экзоглюканазную
активность определяли по гидролизу фильтровальной бумаги (ФБ активность).
Редуцирующие вещества определяли методом с ДНС реактивом после инкубации 1 мл
культуральной жидкости и 1 мл 0,05 М цитратного буфера (рН 4,5) с
фильтровальной бумагой (1х6 см) при температуре 50˚С в течение 1 ч. [1].
Содержание
белка в культуральной жидкости определяли по методу Бредфорд.
Результаты
и обсуждение.
Нами
была показана способность исследованного штамма Fusarium sp. к
росту на питательной среде с фильтровальной бумагой в качестве единственного
источника углеродного питания и продуцированию на ней внеклеточных ферментов
целлюлозолитического комплекса в условиях глубинного культивирования. При этом
наблюдалась длительная фаза адаптации (до 3 суток) с низкой скоростью роста,
целлюлолитической активностью и концентрацией белка в среде. После фазы
адаптации наблюдается индукция синтеза внеклеточных целлюлаз. Процесс
культивирования завершался на этапе практически полного гидролиза
фильтровальной бумаги. При этом наблюдаемая динамика роста культуры
(преимущественно мицелиальный), разрушения бумаги (визуальная оценка), увеличения
эндоглюканазной активности и накопления белка в культуральной среде была
практически синхронной (рис. 1). Концентрация белка на 8-е сутки роста культуры
составляла 0,040 мг/мл, что обуславливало достаточно высокие уровни удельной
активности (рис. 3).
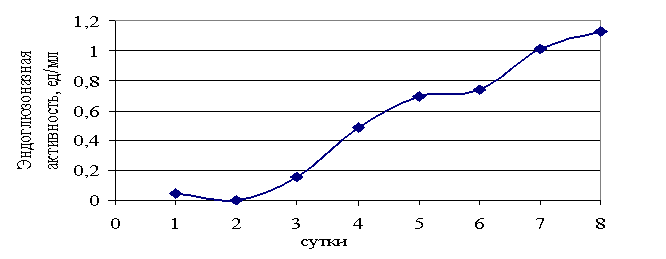
Рис.1. Динамика эндоглюконазной
активности при росте Fusarium sp. на
питательной среде с фильтровальной бумагой.
В
отличие от эндо- экзоглюканазная активность имела ярко выраженный максимум на 4
сутки культивирования гриба и практически не определялась на 3 и 5 сутки (рис.
2). Характер изменения экзоглюканазной активности Fusarium sp., по сравнению с эндоглюканазой,
свидетельствует о том, что индукция этого фермента носит более стремительный
характер. Известно, что нерастворимая кристаллическая целлюлоза является
сильным специфическим индуктором синтеза целлюлаз. Каталитический гидролиз
кристаллических участков целлюлозы происходит исключительно под действием
экзоглюканазы, а синергетический эффект
эндоглюканазы начинает сказывать на более поздних этапах реакции.
Падение активности экзоглюканазы на 5-е сутки культивирования можно объяснить
большей чувствительностью этого фермента к процессу катаболической репрессии
глюкозой, которая в последствии потребляется культурой гриба.
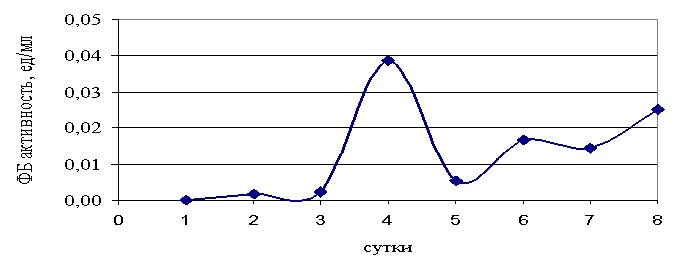
Рис.2. Изменение ФБ активности
при культивировании Fusarium sp. на
питательной среде с 0,5% фильтровальной бумагой.
Наибольшее значение
удельной эндоглюконазной активности, превалирующей в культуральной жидкости
исследованного гриба, зафиксировали на 4 сутки выращивания (рис. 3), что
совпало с максимумом экзо-, а не эндоглюканазной активности.
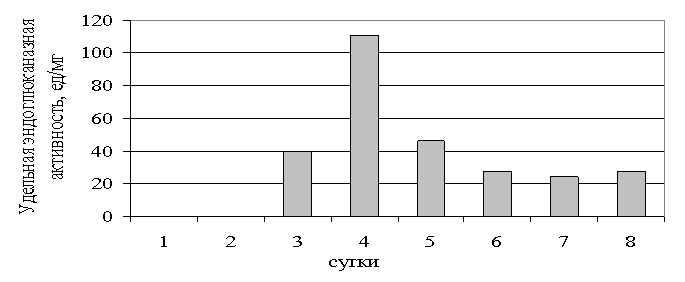
Рис.3.
Удельная эндоглюканазная активность при культивировании Fusarium sp. на питательной среде с 0,5%
фильтровальной бумагой.
Таким образом, нами было
установлено, что индукция синтеза компонентов целлюлазного комплекса Fusarium sp. при росте на фильтровальной бумаге приводит к различной
динамике изменения активности внеклеточных целлюлаз.
СПИСОК ЛИТЕРАТУРЫ
1. Ghose T.K. Measurement of Cellulase Activities // Pure & Appl. Chem.
– 1987. – 59, N 2. – P. 257—268.
2. Kumar D., Murthy G. S.
Stochastic molecular model of enzymatic hydrolysis of cellulose for ethanol
production// Biotechnology for
Biofuels 2013. – V.6. –N 63, . – 20 p.
3. Lee J.M.,
Heitmann J.A., Pawlak
J.J. Rheology of
carboxymethyl cellulose solutions treated with cellulases.//
BioResources. 2007. – V. 2. – N 1. – P.20-33
4. Zhang Y.H.P., et al. Cellulase
Assays // in: Mielenz (ed.), Biofuels: Methods and Protocols, Methods in
Molecular Biology, 2009. – V. 581. – Р.
213 – 231