Химия и химические технологии
к.т.н., доц. Фомин А.А.1, д.т.н., проф. Родионов И.В.1,
к.т.н., доц. Пошивалова Е.Ю.1, студ. Фомина М.А.1, студ.
Штейнгауэр Н.Н.1, к.ф.-м.н. Захаревич А.М. 2, м.н.с.
Петрова Н.В. 2, асп. Грибов А.Н.2
1Саратовский государственный технический
университет
имени Гагарина Ю.А., Россия
2Саратовский государственный университет
имени Н.Г. Чернышевского, Россия
Научные исследования проведены при частичной финансовой поддержке: гранта РФФИ № 13-03-00898 «а», гранта Президента РФ № МД-97.2013.8, стипендии Президента РФ № СП-1051.2012.4, а также по программе «У.М.Н.И.К.».
Химический состав,
структура и физико-механические свойства оксидных нанопористых покрытий,
полученных при индукционно-термической обработке титановых имплантатов
Введение
Технический титан и
его медицинские сплавы применяются для изготовления элементов конструкций
эндопротезов, дентальных имплантатов, а также чрескостных остеофиксаторов.
Данные металлоконструкции подвергаются поверхностной обработке с целью получения
переходного биофункционального слоя – покрытия, которое способствует ускорению
остеоинтеграционных процессов [1]. Более двух десятков лет для этой цели
использовались кальций-фосфатные материалы (гидроксиапатит, трикальцийфосфат),
биостекла, однако эти материалы обладают определенными недостатками, такими как
низкая прочность, твердость, трещиностойкость и износостойкость. Механические
свойства традиционно используемых биосовместимых металлов могут подходить для
имплантируемых конструкций кратковременного функционирования. В случае, когда
необходимо обеспечить долгосрочный период работы (от нескольких месяцев до
десятков лет), необходимо создать специальные условия биомеханического
взаимодействия, предусматривающие высокую химическую и физико-механическую стабильность
свойств покрытия. При установке имплантата с необходимой величиной натяга и в
условиях действия функциональных нагрузок особое внимание уделяется
механическим характеристикам поверхностного слоя, а именно, твердости в
сочетании с необходимой упругостью [2]. Высокие качества биосовместимости
покрытия могут также обеспечиваться показателями морфологической
гетерогенности, а именно наличием нанофазных структур – зерен и пор [3].
Результатом поисковых и
научно-исследовательских работ являются фундаментальные принципы структурной
модификации поверхности технического титана ВТ1-00 токами высокой частоты
(ТВЧ). В результате такой термической обработки формируется биосовместимый
переходный слой с необходимым химическим составом, структурой, а также экстремально
высокими механическими характеристиками. Морфологическая гетерогенность
микроструктуры и однородностью наноструктуры обеспечивается за счет
использования высокоэффективного метода индукционно-термической обработки (ИТО)
[4].
Методика эксперимента
Экспериментальные образцы представляют собой пластины технического титана ВТ1-00 толщиной 2 мм, поверхность которых подвергается пескоструйной обработке корундовым абразивом, а также ультразвуковой очистке. Поверхность подготовленных образцов оксидируется на воздухе при воздействии ТВЧ. Устанавливается влияние ИТО в диапазоне температуры 600…1200 °C на показатели структуры поверхности получаемых покрытий, твердость и модуль упругости. При этом используются растровая электронная микроскопия (РЭМ) и наноиндентирование с нагрузкой не более 100 мН, прикладываемой к алмазному индентору Берковича (ISO 14577, ASTM E 2546). Проверка биосовместимости проводится in vitro на клетках (фибробластах) человека. Образцы покрытий нумеруются в соответствии величиной температуры ИТО, например, 06 – 600 °C, 12 – 1200 °C.
Результаты исследования и их анализ
Результаты РЭМ поверхности образцов показали
наличие пористой металлооксидной матричной структуры (рис. 1).

Рис. 1. Морфология
микро- (а, в) и наноструктуры (б, г) покрытия диоксида титана, полученного
при режиме ИТО 08-120:
а, б – исходная; в, г – после теста in vitro (стрелками показаны
клетки)
Микроструктура поверхности представляет
собой рельеф исходной металлической основы после подготовительных операций и
оксидирования (рис. 1 а). Исследование в нанометровом масштабе
позволяет выявить тонкую структуру, представленную игольчатыми кристаллами
(рис. 1 б). Увеличение температуры ИТО способствует
преобразованию игольчатых нанокристаллов в субмикрометровые кристаллы призматической
формы (рис. 2).

Рис. 2. Морфология
покрытия диоксида титана, полученного
по режиму ИТО 10-120: а –
исходная; б – после теста in vitro
При росте оксидного покрытия происходит образование наружного оксидного слоя игольчатой, затем пластинчатой структуры, под которым параллельно протекают два процесса: рост субмикрокристаллического подслоя и диффузионное насыщение приповерхностного слоя титановой основы. Данные явления можно исследовать по изображениям РЭМ в сочетании с энергодисперсионным анализом химического состава участка нанесенной царапины методом скретч-тестирования (рис. 3).
Твердость в нанометровом масштабе исследования при режиме ИТО 06 характеризуется трехкратным возрастанием до 6 ГПа по сравнению с титановой основой. При режиме ИТО 10-120 твердость достигает максимальных значений и составляет около 10…11 ГПа (рис. 4 а).

Рис. 3. РЭМ участка
царапины покрытия
(точками отмечены участки: 1, 7 – покрытие;
2, 6 – металлическая основа с тонким подслоем;
3, 4, 5 – область воздействия индентора)
Модуль упругости образцов покрытий, полученных при режиме ИТО 06 несколько ниже, чем у титана, однако при режимах ИТО 10 и 12 происходит его увеличение до 400…500 ГПа (рис. 4 б).
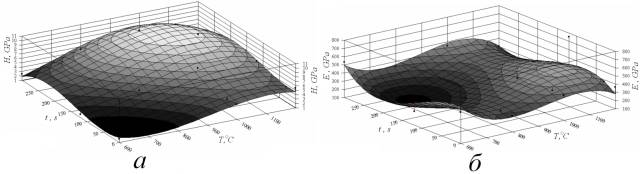
Рис. 4. Зависимости
твердости (а) и модуля упругости (б)
от температуры и продолжительности процесса ИТО
Проверка биосовместимости in vitro получаемых образцов покрытий показала, что высокая морфологическая гетерогенность поверхностной структуры обеспечивает стабильную адгезию фибробластов, в том числе за счет внедрения органического вещества в пористую структуру (рис. 1 в, 1 г, 2 б). Прикрепление клеток происходит наиболее активно в присутствии нанометровых кристаллов и пор, при этом развитая морфология покрытий, полученных при режимах ИТО 08, активно стимулирует процесс биоинтеграции.
Вывод
Обработка ТВЧ титановых медицинских изделий обеспечивает ускоренное образование на их поверхности механически прочной оксидной структуры. Установлено, что тонкослойное металлооксидное покрытие, формируемое при нагреве от 800 до 1200 °C и выдержке не менее 120 сек, характеризуется высокой биосовместимостью и физико-механическими свойствами.
Литература
1. Catledge
S.A., Fries M., Vohra Y.K. Nanostructured surface modifications for biomedical
implants // Encyclopedia of nanoscience and nanotechnology, 2004. – No.
1. – pp. 741–762.
2. Штанский Д.В., Петржик М.И., Башкова И.А., Кирюханцев-Корнеев Ф.В., Шевейко А.Н., Левашов Е.А. Адгезионные, фрикционные и деформационные характеристики покрытий Ti-(Ca,Zr)-(C,N,O,P) для ортопедических и зубных имплантатов // Физика твердого тела, 2006. – № 48. – Вып. 7. – С. 1231–1238.
3. Fomin A.A., Rodionov I.V., Steinhauer A.B., Fomina M.A., Zakharevich A.M., Skaptsov A.A., Petrova N.V. Structure of Composite Biocompatible Titania Coatings Modified with Hydroxyapatite Nanoparticles // Advanced Materials Research, 2013. – Vol. 787. – pp. 376–381.
4.
Fomin A.A., Steinhauer A.B., Rodionov I.V., Petrova N.V., Zakharevich A.M.,
Skaptsov A.A., Gribov A.N. Nanostructure of Composite Bioactive Titania Coatings
Modified with Hydroxyapatite in Medical Titanium Implants // Biomedical
Engineering, 2013. – Vol. 47. – No. 3. – pp. 138-141