Медицина/8. Морфология
к.м.н. Купша
Е.И., доцент Бондаренко В.В.
Государственное учереждение “Крымский государственный медицинский университет
имени С.И. Георгиевского”, АР Крым, Украина
Гладкие миоциты секреторного (синтетического) фенотипа в междольковых
сосудах печени мышей при сочетанном поступлении в организм ацетата свинца и α-токоферола.
Популяция гладких миоцитов (ГМ) сосудов
характеризуется гетерогенностью даже в физиологических условиях. Веретеновидная
форма ГМ сократительного типа имеет низкие показатели пролиферации и индуцируется
к этому фенотипу гепарином и TGF-β. Ромбоидная
форма ГМ характеризуется наибольшей степенью синтеза протеинов, быстрой
пролиферацией и миграционной активностью и индуцируются к этому фенотипу FGF-β. Пусковым событием для фенотипической
трансформации ГМ является изменение структурных компонентов стенки сосуда. Так,
деградация экстрацеллюлярной матрицы в ходе сосудистой альтерации индуцирует
миграцию ГМ с целью ее реконструкции и образования неоинтимы [1]. Повреждение и
десквамация эндотелия, поддерживающего в норме сократительный фенотип ГМ и их контакты
с межклеточным веществом, содействует дедифференцировке ГМ в синтетический
(профибротический) фенотип с последующей миграцией в субэндотелиальное
пространство и секрецией большого количества межклеточного вещества и матричных
металлопротеиназ [2].
Свинцовая интоксикация моделировалась нами на самцах
белых мышей линии balb/c, которым, начиная с 1-месячного возраста, ежедневно
перорально вводили ацетат свинца в дозе 10 мг/кг/сутки и масляный раствор
альфа-токоферола ацетата в дозе 2 мг/кг
в течение 30 и 60 суток – 12 животных.
При одновременном введении ацетата свинца и альфа -
токоферола приоритетными клеточными мишенями для развивающихся деструктивных,
дистрофических и саногенетических процессов являются гепатоциты, эндотелиоциты
и эритроциты. Однако, в дополнение к ним, активное участие в ответной реакции
ткани печени на введение свинца и токоферола принимают гладкие миоциты стенки
междольковых сосудов и клетки фибробластического дифферона. В стенке портальных
сосудов, прилежащих к участкам паренхимы, не затронутых обширным некротическим
процессом, наблюдаются признаки адаптивно-компенсаторных и защитных реакций.
Отмечается гиперплазия клеток tunica
media и adventitia,
сопровождающаяся усиленной продукцией основного вещества и волоконного
компонента. В 30-сут. серии выражена
воспалительная макрофагально-лимфоцитарная инфильтрация, гиперпродукция
основного вещества и волоконного компонента в стенке портальных сосудов, причем
активное участие в секреторной реакции принимают гладкие миоциты междольковых сосудов и клетки
фибробластического дифферона. Эндотелий междольковых сосудов подвергается
умеренной гидропической дистрофии. Местами обнаруживаются очаговые утолщения
средней оболочки междольковых вен за счет усиленной пролиферации гладких
миоцитов секреторного типа. Они имеют крупные удлиненные ядра, заостренные на
одном полюсе. Вокруг этих клеток выявляется значительное накопление
межклеточного вещества. К адвентиции в этих участках прилежат клетки фибробластического
и макрофагического ряда (рис. 1. А). В
серии 60-сут. также отмечена гиперпродукция межклеточного вещества, что
свидетельствует об успешной реализации программы «ген-белок-признак»,
позволяющий продвинуть адаптивно-компенсаторные реакции с клеточного уровня на
тканевую составляющую. В междольковых артериях гладкие миоциты средней
оболочки, следуя общей логике компенсации нарушенных гемомикроциркуляторных
параметров, изменяют свою микротопографию из обычной циркулярной ориентации на
поперечных срезах в радиально ориентированные клетки с секреторной активностью,
что сопровождается усиленной продукцией межклеточного вещества (рис. 1. В).
Реконструкция интимы при повреждении эндотелия в
артерии происходит за счет средней оболочки, а вены – адвентициальной.
Моноциты/макрофаги стимулируют пролиферацию гладких миоцитов. Сосудистое
повреждение индуцирует фенотипичную модуляцию в направлении пролиферативного,
дедифференцированного, миграционного фенотипа ГМ с увеличенной секрецией
межклеточного вещества, что содействует клеточной гиперплазии, по мнению ряда
авторов [2].
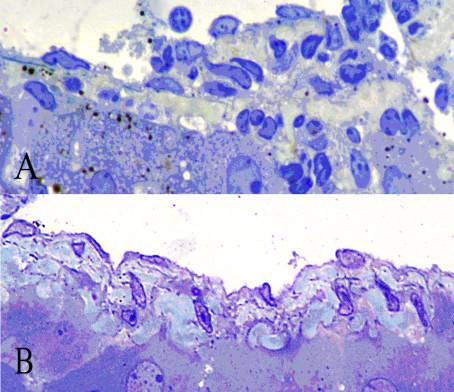
Рис.
1. А - серия 30 сут. Локальная гипертрофия стенки междольковой вены. Накопление
межклеточного вещества вокруг гладких миоцитов. Полутонкий срез. Толуидиновый
синий. Ув. х 400. В - серия 60 сут. Гладкие миоциты междольковой артерии.
Гидропическая дистрофия и пикноз ядер эндотелиоцитов. Полутонкий срез.
Толуидиновый синий. Ув. х 400.
Такие ответные реакции со
стороны тканевых компонентов, как гиперплазия клеточных элементов в стенке
междольковых сосудов, усиление продукции ими межклеточного вещества, тем не
менее можно отнести к несовершенным, незавершенным компенсаторно-адаптивным
эффектам, как и наблюдаемые нами в серии 30-сут.
Активирующее действие
α-токоферола на секреторную активность соединительнотканных и
гладкомышечных клеток в составе оболочек междольковых сосудов, что выявляется в
форме усиленного коллагенообразования, можно трактовать двояко. С одной
стороны, эта защитная реакция отграничивает экспансию токсических метаболитов в
центральные участки гепатических ацинусов, с другой, несет черты компенсаторной
патологии и служит морфологическим базисом возможного прогрессирования процессов
фиброза паренхимы.
Литература:
1. Akihito Muto. Smooth Muscle Cell Signal
Transduction: Implications of vascular
biology for vascular surgeons / Akihito Muto,
Tamara N Fitzgerald, Jose M Pimiento, Stephen Maloney, Desarom Teso, Jacek J
Paszkowiak, Tormod S Westvik, Fabio A Kudo, Toshiya Nishibe, Alan Dardik.// Vasc Surg. – 2007. – Vol. 45(6S) – P.15-24.
2. Eva M. Rzucidlo. Regulation of vascular smooth muscle cell
differentiation / Eva M. Rzucidlo,
Kathleen A. Martin, Richard J. Powell, Lebanon, NH. // Vasc Surg. – 2007. – Vol.45 – P.25A-32A.