рахимбеков А.Ж., Нурбосынова Г.С., Садуакасова
Р.А.,
Аманкелдыкызы Н.А.,
Муфтахтинова Г.С.
Жетысуский
Государственный университет им. И.
Жансугурова, Республика Казахстан
Кулонометрическое измерение концентраций кислорода в
газах
В применении
метода кулонометрического титрования кислорода перспективны материалы на основе оксидов IV В –
примесные твердые оксидные суперионные проводники (ТОСП), называемые также
высокотемпературными или твердыми оксидными электролитами. Они отличаются
исключительно кислородноионным переносом в широком диапазоне температур Т, и
парциальных давлений кислорода Р [1].
В этом случае отпадает необходимость в регуляторе температуры в эталонном
газе.
На внешнюю и внутреннюю поверхности ТОСП наносятся и спекаются газопроницаемые
электроды из каталитически активного металла (платина, золото, серебро и др). К
электродам предъявляются следующие требования: прочный равномерный контакт с
твердым электролитом по всей поверхности; малые диффузионные и электрическое
сопротивления. В цилиндрической высокотемпературной печи нагревается рабочая
часть ТОСП до температуры 400-10000С с, при которой перенос тока
через электролит обеспечивается только ионами кислорода. В установившемся режиме (расход газа через
ТОСП постоянный и отсутствуют иные механизмы проводимости, кроме
кислородноионной) зависимость между током переноса и концентрацией в
соответствии с законом Фарадея
выражается соотношением:
![]() (1)
(1)
где С-концентрация кислорода, ррm; I- ток, мка; Q- расход газа (при н.у.),
см3/с; М- молекулярный вес кислорода; F- число Фарадея; n- число зарядов,
необходимых для переноса одной молекулы кислорода [2].
Показания
ТОПС зависят только от входной концентраций и расхода газа, причем колебания температуры
окружающего воздуха и барометрического давления оказывают косвенное влияние на
расход газа.
Напряжение
питания должно быть достаточным лишь для практически полного переноса кислорода
без превышения величины потенциала разложения электролита. Рассмотрим
зависимость между выходным сигналом ТОСП и его параметрами при следующих
ограничениях: режим течения газа внутри ТОСП – ламинарный; выход потоку-100%; компоненты газа химически не взаимодействуют с
материалом электрода и электролита.
Все
процессы, протекающие в ТОСП, разделяются на массоперенос кислорода из потока к
поверхности электрода; адсорбцию на электроде; массоперенос через пористый
электрод к границе раздела электрод – электролит и ионизацию атомов; перенос
через электролит. Надо учесть, что скорости процессов внешнего массообмена,
адсорбции и ионизации атомов в условиях рабочей температуры ТОСП велики,
примем, что основные кинетические затруднения обусловлены процессами диффузии
кислорода через электрод и его переноса через электролит.
Для вывода
уравнения материального баланса рассмотрим элементарный участок ТОСП, приняв,
что С0-концентрация кислорода в окружающей атмосфере [3].
В
объеме, ограниченном сечениями Х1 и Х2 за время ∆t остается кислорода:
![]() (2)
(2)
через
электрод к поверхности раздела за время ∆t диффундирует кислорода:
![]() (3)
(3)
где Р-коэффицент проницаемости
электрода; ![]() -концентрация
кислорода на границе раздела фаз электрод-электролит;
-концентрация
кислорода на границе раздела фаз электрод-электролит; ![]() -толщина
электрода; d-внутренний диаметр ТОСП.
-толщина
электрода; d-внутренний диаметр ТОСП.
Под дейстивем приложенного напряжения
через электролит за время ∆t током переносится кислорода
![]() (4)
(4)
где ![]() -эффективная
удельная проводимость электролита, равная К
-эффективная
удельная проводимость электролита, равная К![]() ;
; ![]() -
удельная проводимость электролита; К- коэффициент, определяемый
экспериментально и равный отношению эффективной поверхности рабочей зоны ТОСП к
общей ее поверхности; b- толщина
стенки ТОСП;
-
удельная проводимость электролита; К- коэффициент, определяемый
экспериментально и равный отношению эффективной поверхности рабочей зоны ТОСП к
общей ее поверхности; b- толщина
стенки ТОСП; ![]() - действующее напряжение. Приравнивая (2) и
(3), получим уравнение материального баланса:
- действующее напряжение. Приравнивая (2) и
(3), получим уравнение материального баланса:
![]() (5)
(5)
На электродах
перегородки из такого материала, разделяющий объемы с С1 > С2, существует электродвижущая
сила (ЭДС) Е:
E = ![]() ln
ln ![]() (6)
(6)
(здесь R-
универсальная газовая постоянная, F – число Фарадея,
Т-температура окружающей среды, С1 - парциальное давление кислорода
в окружающей атмосфере равное 0.21![]() 105 Па, С2 – искомое давление кислорода). Это явление используют в топливных элементах,
термодинамических исследованиях, газовом анализе.
105 Па, С2 – искомое давление кислорода). Это явление используют в топливных элементах,
термодинамических исследованиях, газовом анализе.
Развитие получил кислородный насос (КН) –
устройство дозирования кислорода в газовом потоке (рис.1). Пропуская через такую
перегородку ток от внешнего источника, дозируют кислород в одном из объемов. В
этом состоит принцип кислородного насоса. В случае дозирования кислорода в
газовом потоке перегородкой служит стенка трубки, которая с одной парой
электродов образует качающую КС, с другой – измерительную секцию (КС и ИС). По
трубке со скоростью ![]() пропускают инертный газ с
концентрацией кислорода С1. Значение С на выходе кислородного насоса (КН) зависит от
величины тока I
в цепи КС:
пропускают инертный газ с
концентрацией кислорода С1. Значение С на выходе кислородного насоса (КН) зависит от
величины тока I
в цепи КС:
I=![]() ln
ln ![]() (7)
(7)
где r – сопротивление перегородки
или стенки трубки кислородного насоса.

![]()
![]() газ
газ
газ
газ
![]() J, С1 J, С2
J, С1 J, С2
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() R
R
Е
Рис.1
![]()
![]() Определяют С2 по величине Е, измеряемой на электродах измерительной секции ИС:
Определяют С2 по величине Е, измеряемой на электродах измерительной секции ИС:
(8)
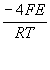
С2 = С1 ехр
( )
(здесь С1 –
концентрация, или парциальное давление кислорода вне трубки равное 0.21![]() 105Па) [4].
105Па) [4].
Литература
1. Chandra S.
Superionic Sol., North-Holland, 1981. 885 p.
2. Phys., Superionic
Conductors/ed. M. B. Salamon, Springer – Verlag, Berlin-Heidelberg-New York,
1979. 364 p.
3.
Укше Е.А., Букун Н.Г.
Твердые электролиты. М.: Наука, 1977. 146 с.
4. Чеботин В.Н., Перфильев М.В. Электрохимия твердых электролитов. М.: Химия, 1978. 345 с.