Биология
К.б.н. Волкова В.В.1, к. с.-х.
н. Седых Т.А.2
1ГНУ Всероссийский
научно-исследовательский институт животноводства
Россельхозакадемии,
Россия
2ФГБОУ ВПО «Башкирский государственный
аграрный университет», Россия
Использование
полиморфизма микросателитных
локусов крупного
рогатого скота для оценки
общности происхождения
Введение. В реализации Подпрограммы развития
мясного скотоводства на период 2013-2020 гг. одним из основных мероприятий
значится развитие племенной базы мясного скотоводства, где среди прочих не
менее важных, определено направление по стимулированию селекционной работы,
направленной на совершенствование племенных и продуктивных качеств
сельскохозяйственных животных. Таким образом, создаются все условия для
устойчивого развития отрасли специализированного мясного скотоводства и производства
высококачественной говядины в Российской Федерации [4].
С целью развития мясного
скотоводства в Республику Башкортостан в 2009 г. был завезен из Австралии крупный рогатый скот герефордской
породы, представленный популяциями, разводимыми в штатах Южная Австралия, Виктория,
Новый южный Уэльс и на о. Тасмания. В хозяйствах, где содержатся животные,
используется стойлово-пастбищная технология содержания мясного скота,
практикуются туровые отелы в зимне-стойловый период. Первые 6-8 дней
новорожденных телят содержат в индивидуальных боксах совместно с матерями,
затем коров переводят на выгульные площадки и используют режимный подсос.
Раздельное содержание коров и молодняка обеспечивает лучшие зоогигиенические
условия для телят и сокращает затраты. В летний период коровы и телята
содержатся на естественных пастбищах, осенью в конце пастбищного периода
молодняк переводится на доращивание и на откормочные площадки, где находятся,
как правило, до 18-20-месячного возраста. Коровы и быки содержатся зимой на кардах
[2,3].
В настоящее время
для объективной характеристики видов и пород сельскохозяйственных животных
широко используются молекулярно-генетические маркеры и одним из
высокоинформативных типов ДНК-маркеров, характеризующих генофонд, являются микросателиты
[6,8]. Микросателлиты
являются удобными генетическими маркерами в геноме сельскохозяйственных животных
вследствие высокого уровня полиморфизма и стабильного аутосомного кододоминантного
наследования [5,9,10].
Целью работы
стало исследование аллелофонда крупного рогатого скота герефордской породы
различных эколого-генетических генераций и использование полиморфизма микросателитных локусов
для оценки общности происхождения.
Материалы
и методы исследований. Исследования
проводились на базе ЦКП «Биоресурсы и биоинженерия сельскохозяйственных
животных» ГНУ ВИЖ Россельхозакадемии. Материалом для исследований служили пробы
ткани (ушной выщип) крупного рогатого скота герефордской породы трёх генетико-экологических
генераций в количестве 66 голов, разводимых в МТС «Центральная» Республики
Башкортостан, в т.ч. завезённые из Австралии, (ГРФ_АВСТР, n=30), первой российской генерации,
(ГРФ_F1, n=26) и второй российской генерации (ГРФ_F2, n=10).
Выделение ДНК проводили с помощью набора
реагентов для выделения ДНК DIAtomTM DNA Prep100 (ООО «Лаборатория Изоген»,
Россия). Анализ ДНК и постановку ПЦР проводили по методикам, разработанным
ранее [7]. Набор маркеров для анализа включал 9 микросателлитных локусов -
TGLA126, TGLA122, TGLA227, ILST005, ETH185, ETH10, ETH225, BM1818 и BM2113.
Фрагменты амплификации идентифицировали на генетическом анализаторе ABI Prism
3130xl («Applied Biosystems», США). Статистическую обработку данных проводили
по стандартным методикам [1] с использованием программного обеспечения GenAlEx
v 6.4 [12] в соответствии с методическими подходами, разработанными в ГНУ ВИЖ
РАСХН [11].
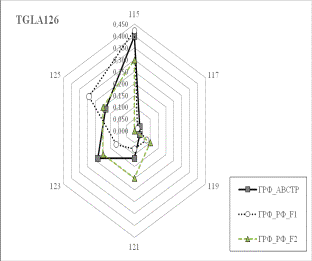
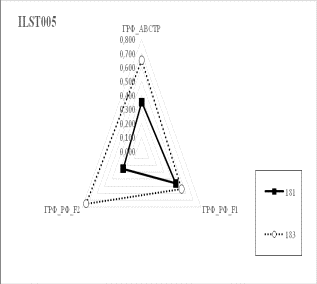
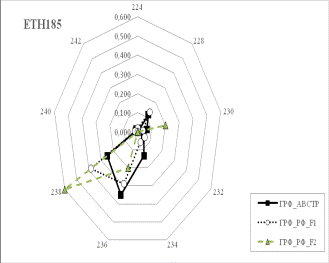
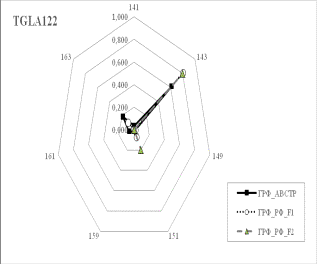
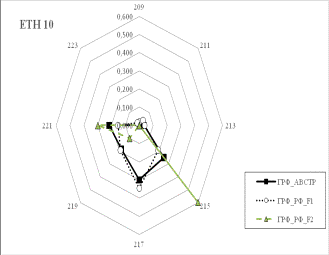
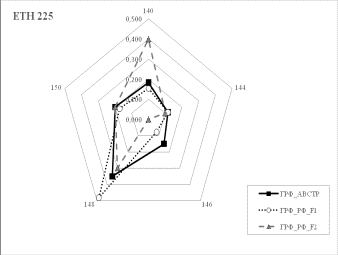
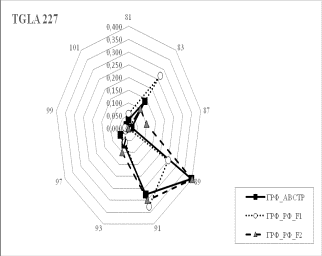
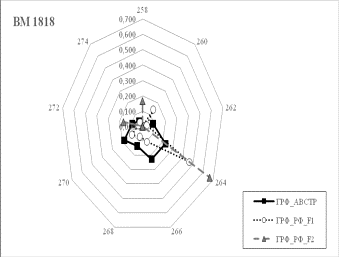
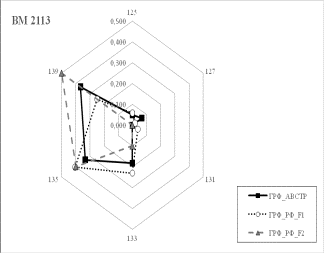
Результаты собственных исследований. На
рисунке 1 (а, б, в, г, д, е, ж, з, и) представлены частоты аллелей 9 изученных
микросателлитных локусов.
|
|
|
|
а) |
б) |
|
|
|
|
в) |
г) |
|
|
|
|
д) |
е) |
|
|
|
|
ж) |
з) |
|
|
и) Рисунок
1 Аллельные частоты по микросателлитным маркерам в разрезе генераций герефордского
скота |
По ряду локусов между
различными генетико-экологическими генерациями отмечаются довольно значительные
различия по частотам аллелей. Так, частота аллеля 238 локуса ETH185 возрастает
от 0,18 у завезённых герефордов (ГРФ_АВСТР) до 0,4 у ГРФ_F1 и 0,6 у ГРФ_РФ_F2. Частоты аллеля 215 локуса ETH10 и аллеля 264 локуса BM1818
также повышаются от 0,1 до
0,6 и от 0,2 до 0,7 соответственно у ГРФ_АВСТР
ГРФ_РФ_F2. У ГРФ_РФ_F2 частота аллеля 140 локуса ETH225 выше в 4 раза по сравнению с
исходной ГРФ_АВСТР.
Число аллелей в исследованных локусах варьирует от 2
в локусе ILST005 до 9 в локусах
ETH185, TGLA227 и BM1818. Суммарно в
изученной популяции животных выявлено 66 аллелей.
На рисунке 2 представлен
анализ пространственного распределения изученных генераций герефордского скота,
проведённый на основании генотипа по микросателлитам
каждого исследованного животного, а также на количестве и частоте встречаемости
аллелей, общих для каждой группы.
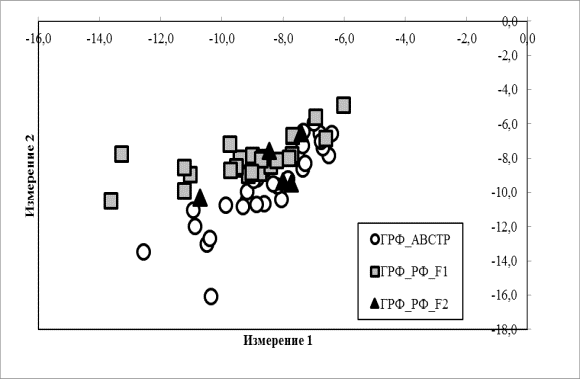
Рисунок 2 Двухмерное распределение в группах скота разных генераций ГРФ_АВСТР,
ГРФ_РФ_F1 ГРФ_РФ_F2
Видно, что все три
генерации представляют собой хорошо консолидированные, частично перекрывающиеся
массивы, что указывает на некоторые различия в ДНК-профилях, с другой стороны,
- на общность происхождения.
Вывод. На основании проведенных исследований полиморфизма
микросателитных локусов популяции крупного рогатого скота герефордской породы
австралийской генерации и их потомков первого (F1) и второго (F2) поколений по 9 микросателлитным локусам
установлено, что в трёх последовательных эколого-генетических генерациях
показано снижение среднего числа аллелей локус с 6,00 до 3,33. Изученные
генерации герефордского скота представляет собой хорошо консолидированные,
частично перекрывающиеся массивы, что указывает, с одной стороны, на некоторые
различия в ДНК-профилях и на общность происхождения - с другой.
Литература:
1.
Вейр Б. Анализ
генетических данных // М.: Мир, 1995. 319 с.
2.
Гизатуллин Р.С.
Хазиахметов
Ф.С., Седых Т.А., Мударисов Р.М. Ресурсосберегающая технология
разведения мясного скота и производства говядины: рекомендации –
Уфа: Издательство Башкирский ГАУ, 2013. 64 с.
3.
Гизатуллин Р.С.,
Седых Т.А. Резервы увеличения производства говядины в Башкортостане // Вестник Башкирского государственного
аграрного университета. 2011. № 3.
С. 25-29.
4.
Государственная
программа развития сельского хозяйства
и регулирования рынков
сельскохозяйственной продукции, сырья и продовольствия на 2013-2020 годы // Постановление
Правительства РФ от 14 июля 2012 г. № 717 (в ред. постановления Правительства
РФ от 015 апреля 2014 г. № 315) UTR:http://mcx.ru/documents/file_document/show/23220.htm
5. Долматова И.Ю. Зиновьева
Н.А., Горелов П.В., Ильясов А.Г., Гладырь Е.А., Траспов А.А., Сельцов В.И.
Особенности аллелофонда башкирской популяции симментальского скота по
микросателлитам// Сельскохозяйственная биология. 2011. №6. С. 70-74.
6.
Зиновьева Н.А., Гладырь Е.А. Генетическая
экспертиза сельскохозяйственных животных: применение тест-систем на основе
микросателлитов // Достижения науки и техники АПК. 2011. № 9. С. 46-48.
7.
Зиновьева Н.А.,
Попов А.Н., Эрнст Л.К., Марзанов Н.С., Бочкарев В.В., Стрекозов Н.И., Брем Г.
Методические рекомендации по использованию метода полимеразной цепной реакции в
животноводстве // Дубровицы. ВИЖ, 1998. 47 с.
8.
Зиновьева Н.А., Стрекозов Н.И.,
Молофеева Л.А. Оценка роли
ДНК-микросателлитов в генетической характеристике популяции черно-пестрого
скота // Зоотехния. 2009. № 1. С.
2-4.
9.
Стрекозов
Н.И., Зиновьева Н.А., Горелов П.В., Листратенкова В.И., Коновалова Е.Н.,
Чернушенко В.К., Эрнст Л.К. Генетическая характеристика созданных типов скота
бурой швицкой и сычевской пород с использованием полиморфизма микросателлитных
локусов// Сельскохозяйственная биология. 2009. № 2. С. 10-15.
10.
Траспов
А.А., Зиновьева Н.А., Долматова И.Ю., Гладырь Е.А. Аллелофонд башкирской
популяции черно-пестрого скота по микросателлитам в связи с показателями молочной
продуктивности коров // Проблемы биологии продуктивных животных. 2011. Т. 1. С.
65-68.
11.
Nei, M. 1978. Estimation of
average heterozygosity and genetic distance from a small number of individuals.
Genetics 76: 379-390.
12.
Peakall, R., Smouse P.E. GENALEX
6: Genetic analysis in Excel. Population genetic software for teaching and
research. //. Molecular Ecology Notes, 2006, 6, 288-295. V. GENALEX 6.4 UTR: http://appliedpopulationgenetics2010.wikispaces.com/file/view/GENALEX6.4_documntation.pdf,
(дата
обращения
19.12.2010).