1Василькевич А.И., 2Биричевская Л.Л., 2Лузина
Е.Б., 1Кисель М.А.,
2Зинченко А.И.
1Институт биоорганической химии НАН Беларуси, Минск
2Институт микробиологии НАН Беларуси, Минск
ИСПОЛЬЗОВАНИЕ 31Р-ЯМР-СПЕКТРОСКОПИИ
ДЛЯ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНОГО ПРЕВРАЩЕНИЯ ФОСФАТИДИЛХОЛИНА В
ФОСФАТИДИЛСЕРИН
Реакция трансфосфатидилирования, катализируемая
фосфолипазой D (ФЛД), широко применяется в синтезе разнообразных
фосфолипидов для пищевой и фармацевтической промышленности [1]. К числу таких
фосфолипидов относится малораспространенный в природных источниках фосфатидилсерин
(ФС), привлекающий в последние годы особое внимание исследователей из-за своих
уникальных фармакологических свойств.
ФС используется в качестве
пищевой добавки, которая способна поддерживать ряд функций головного мозга,
связанных с памятью и способностью к обучению. Отмечено, что ФС может
сглаживать симптомы депрессии, физического, умственного и эмоционального
стресса, а также обладает эргогенными свойствами [2, 3]. Данное соединение
может применяться в качестве средства против остеопороза [4], имеет перспективы
применения в косметологической промышленности [5, 6]. Недавние исследования
показали возможность применения данного фосфолипида в качестве компонента
противомикробных препаратов [7], а также для лечения последствий инфарктов и
инсультов [8]. Дефицит
ФС в организме невозможно устранить за счет питания, хотя он содержится во
многих пищевых продуктах, но в незначительных количествах. Выделение ФС из
наиболее богатого этим фосфолипидом мозга крупного
рогатого скота с последующим использованием в качестве субстанции
пищевой добавки сопряжено с опасностью контаминации прионными инфекциями. Более перспективным методом получения ФС является
ферментативный синтез с использованием катализируемой ФЛД реакции
трансфосфатидилирования, в которой доступный фосфатидилхолин (ФХ) служит донором
фосфатидильного остатка, а L-серин – акцептором.
Наличие удобного и надежного метода
количественного и качественного анализа смесей фосфолипидов при проведении реакции
трансфосфатидилирования позволяет проводить ее мониторинг, необходимый для
подбора оптимальных условий и параметров реакции. Ранее с этой целью широко
применялся метод тонкослойной хроматографии (ТСХ) с обнаружением исходного фосфолипидного
субстрата и продукта специфическими реагентами. ТСХ – удобный экспресс-метод
качественного анализа фосфолипидов, однако, при необходимости количественного
анализа он значительно усложняется, а для получения точных результатов
необходимо проводить большое количество параллельных измерений.
В данной работе предлагается альтернативный
хроматографическим методам слежения за ходом ферментативной реакции подход с
применением 31P-ЯМР-спектрометрии.
Материалы
и методы. В
качестве продуцента ФЛД использовали отобранный нами ранее штамм Streptomyces netropsis БИМ
В-235 (далее Str. netropsis).
Культивирование стрептомицета и получение сухого ферментного препарата
осуществляли, как указано в работе [9].
Ферментативный синтез ФС проводили
в двухфазной водно-органической реакционной смеси (60 об.% хлороформа и
40 об.% водной фазы). Реакционную смесь объемом 10 мл, содержащую 150 мМ L-серин,
30 мМ ФХ, 0,2 М натрий-ацетатный буфер (рН 6,0), 0,1 М CaCl2 и 4
мг сухого ферментного препарата, инкубировали при 37оС и постоянном
перемешивании. За ходом реакции следили, используя ТСХ в системе растворителей хлороформ: метанол: 25%-ный водный аммиак (7:4:1 по
объему). Вещества обнаруживали, используя специфический реагент на фосфолипиды [10]
и 0,25% раствор нингидрина в ацетоне.
Для исследования
динамики изменения фосфолипидного состава реакционной смеси отбирали пробы,
содержащие 15–20 мг суммарных фосфолипидов. После разделения водной и
хлороформной фаз путем центрифугирования (1 мин при 3000 g), органическую фазу аккуратно отбирали с
помощью микропипетки и упаривали на роторном испарителе. К образовавшейся пленке
фосфолипидов добавляли раствор детергента CHAPS в дейтерированной воде (100
мг/мл), встряхивали до образования прозрачного мицеллярного раствора. 31P-ЯМР-спектры
регистрировали на приборе Avance 500 («Bruker»,
Германия) при частоте 272 МГц.
Результаты
и обсуждение.
В отличие от описанных
ранее приёмов анализа фосфолипидного состава с помощью 31P-ЯМР-спектрометрии в данной работе в
качестве детергента для солюбилизации фосфолипидов в воде использован
цвиттер-ионный 3-[(3-холамидопропил)-диметиламино]-1-пропансульфонат (CHAPS),
ранее предложенный для мониторинга ферментативного превращения ФХ в фосфатидилглицерин
[11]. Замена используемого в других работах анионного холата натрия (см. обзор [12]
и цитируемые в нем статьи) на детергент CHAPS избавляет от необходимости
контролировать pH образца, а разрешение сигналов в спектре не зависит от
присутствия ионов двухвалентных металлов, в частности Са+2,
являющегося кофактором ФЛД. Пример 31P-ЯМР-спектра смеси фосфолипидов из соевых
бобов (азолектина) в мицеллах из CHAPS
представлен на рис. 1.
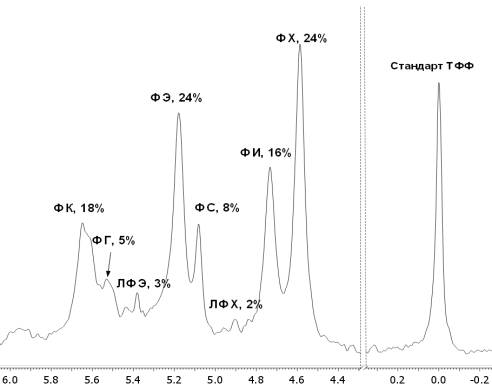
Рис. 1. 31P-ЯМР-спектр смеси фосфолипидов из соевых бобов
ТФФ – трифенилфосфин; ФХ
– фосфатидилхолин; ФИ – фосфатидилинозит; ЛФХ – лизофосфатидилхолин; ФС –
фосфатидилсерин; ФЭ – фосфатидилэтаноламин; ЛФЭ – лизофосфатидилэтаноламин; ФГ
– фосфатидилглицерин; ФК – фосфатидная кислота
В качестве внутреннего
стандарта при регистрации спектра использован раствор трифенилфосфина в дейтерохлороформе,
запаянный в капилляр. Сигнал ядер фосфора в трифенилфосфине находится в
значительно более сильном поле по сравнению с фосфолипидами и не перекрывается
ни с одним из них (рис.1). В большинстве работ для этой цели применяется
фосфорная кислота (см. обзор [12] и цитируемые в нем статьи), которая добавляется
непосредственно в образец, изменяя при этом pH(D) среды и, как следствие, структуру
мицелл. Более того, сигнал фосфорной кислоты находится в области химических
сдвигов фосфолипидов и может перекрываться с сигналами некоторых из них.
Ферментативный синтез ФС осуществляли в
двухфазной системе хлороформ-вода, используя ФХ из соевых бобов в качестве
донора фосфатидильного остатка и L-серин в качестве
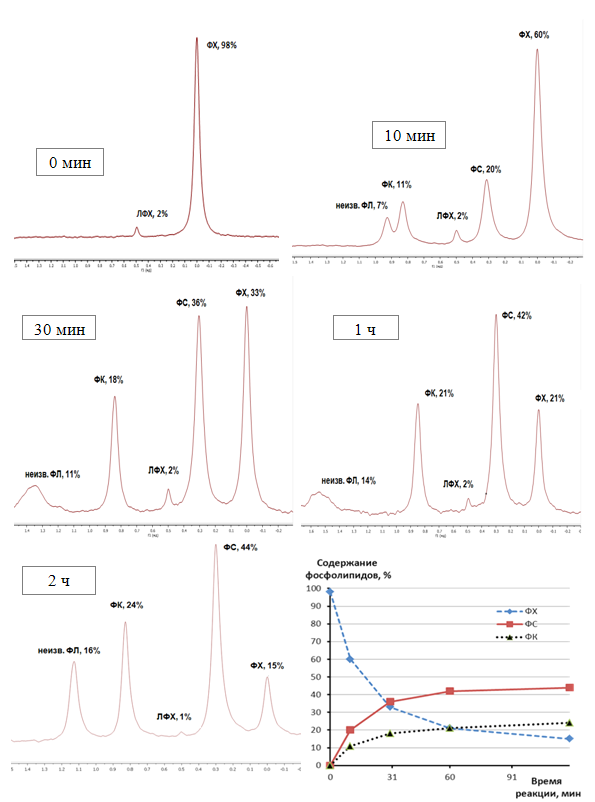
акцептора. Из реакционной смеси отбирали пробы объемом 1 мл через 10 мин, 30
мин, 1 ч и 2 ч после начала реакции. Результаты 31P-ЯМР-спектрометрического
анализа содержания фосфолипидов в хлороформной фазе представлены на рис. 2.
![]()
![]()
![]() Рис. 2. Динамика изменения фосфолипидного состава
реакционной смеси при синтезе ФС с помощью ФЛД
Рис. 2. Динамика изменения фосфолипидного состава
реакционной смеси при синтезе ФС с помощью ФЛД
Химический
сдвиг ФХ в спектрах 31Р-ЯМР реакционной смеси принят за нуль.
Как видно из рисунка,
в реакционной смеси происходит накопление ФС (до 44% от общего количества
фосфолипидов), в меньшем количестве – ФК (до 24%), а также неизвестного
фосфолипида (до 16%). Количество ФХ уменьшается в ходе реакции. По данным
интегральной интенсивности сигналов ФХ, ФС и ФК в спектрах 31Р-ЯМР
построен график, отражающий динамику накопления продуктов реакции и убыли ФХ в
реакционной смеси. Как следует из графика, накопление ФС практически
заканчивается уже через 45 мин после начала реакции. Рассчитанная нами
активность ФЛД в синтезе ФС составила около 1540 ед/мг сухого ферментного
препарата.
Результаты проведенных
исследований дают основание утверждать, что метод 31P-ЯМР-спектроскопии
может быть успешно использован для исследования кинетики реакции
биокаталитического синтеза ФС из ФХ и L-серина. Обнаруженное в результате применения этого
метода неидентифицированное фосфорсодержащее соединение, содержание которого
растет в ходе ферментативной реакции,
является предметом наших дальнейших исследований.
Литература:
1.
Damnjanovic J., Iwasaki Y. Phospholipase D as
a catalyst: application in phospholipid synthesis, molecular structure
and protein engineering // J. Biosci. Bioeng. 2013. Vol.
116, № 3. P.
271–280.
2. Hellhammer J., Fries E., Buss C. et al. Effects of soy lecithin phosphatidic acid and phosphatidylserine
complex (PAS) on the endocrine and psychological responses to mental stress //
Stress. 2004. Vol. 7, № 2. P. 119–126.
3. Jager R., Purpura M., Geiss K.R. et al. The effect of phosphatidylserine on golf performance // J. Int. Soc.
Sports Nutr. 2007. Vol. 4, № 1. P. 23–27.
4. Xu C., Zheng Z., Fang L. et al. Phosphatidylserine enhances
osteogenic differentiation in human mesenchymal stem cells via ERK signal
pathways // Mat. Sci. Eng. C. Mater Biol. Appl. 2013. Vol. 33, № 3. P.
1783–1788.
5. Gilchrest B.
Skin aging and photoaging: an overview // J. Am. Acad. Dermatol. 1989. Vol. 21.
P. 610–613.
6.
Varani J., Warner R.L., Gharaee-Kermani M. et al. Vitamin A antagonizes decreased
cell growth and elevated collagen-degrading matrix metalloproteinases and
stimulates collagen accumulation in naturally aged human skin // J. Invest.
Dermatol. 2000. Vol. 114, № 3. P. 480–486.
7. Tietjen G.T., Gong Z., Chen C.H. et al. Molecular mechanism for differential recognition of
membrane phosphatidylserine by the immune regulatory receptor Tim4 // Proc. Natl. Acad. Sci. USA. 2014. Vol. 111, N 15. P.
1463–1472.
8. Naresh N.K., Xu Y., Klibanov A.L. et al. Monocyte and/or macrophage
infiltration of heart after myocardial infarction: MR imaging by using
T1-shortening liposomes // Radiol. 2012. Vol. 264, № 2. P. 428–435.
9. Birichevskaya L.L., Titovich O.I., Kisel M.A., Zinchenko A.I.
Application of Streptomyces netropsis
phospholipase D for synthesis of phosphatidylserine // Biotechnology, Biodegradation,
Water and Foodstuffs / Eds. G.E. Zaikov, L.P. Krylova. New York: Nova
Science Publishers, Inc., 2009. Р. 65–71.
10. Vaskovsky
V.E., Kostetsky E.Y., Vasendin I.M. A universal reagent for phospholipid analysis
// J. Cromatogr. 1975. Vol. 114, №1. Р. 129-141.
11.
Василькевич А.И.,
Плющевская П.А., Кисель М.А. Новый подход к анализу фосфолипидных смесей методом
31Р-ЯМР спектроскопии // Молекулярные, мембранные и клеточные основы
функционирования биосистем: сб. статей междунар. науч. конф. Минск 17–20 июня
2014, в 2 т. Мн., 2014. Т.1. С.194–196.
12. Schiller J.,
Muller M., Fuchs B. et al. 31P NMR Spectroscopy of Phospholipids:
From Micelles to Membranes. Curr. Anal. Chem. 2013. Vol. 3, №4. P. 283–301.