Береснев А.И.1,
Огнева Е.Н.2, Ерошевская Л.А.1, Квач С.В.1,
Киселев П.А.2,
Зинченко А.И.1
1Институт
микробиологии НАН Беларуси, г. Минск
2Институт биоорганической химии НАН Беларуси, г. Минск
Ферментативный Синтез и цитостатическая
активность кинетинрибозида
Кинетин
представляет собой N6-модифицированный пурин (N6-фурфуриладенин),
который был обнаружен как продукт деградации ДНК молок сельди, способный
стимулировать деление растительных клеток [1]. Долгое время кинетин считался
неприродным (синтетическим) соединением, пока он не был обнаружен в ДНК
человека и растений [2]. Недавно кинетин и его рибозилированное производное
‒ кинетинрибозид идентифицировали в млечном соке кокосового ореха (кокосовое
молоко) [3, 4]. Кинетин влияет на рост листьев и созревание семян в процессе
развития растений (что характерно для фитогормонов цитокининовой природы) и
проявляет ряд важных биологических активностей [5].
Кинетинрибозид
проявляет мощную антипролиферативную активность против клеточных линий
различных видов рака человека, в частности: лейкемии, меланомы, гепатомы,
груди, поджелудочной железы и толстой кишки [6‒8]. Этот нуклеозид также
проявляет цитотоксический эффект в культуре клеток меланомы [9] и лейкемии [10]
мышей. Кроме того, было продемонстрировано, что кинетинрибозид активен против
растительных опухолей [9].
Считается,
что цитотоксические эффекты кинетинрибозида обусловлены его способностью
вызывать быстрое истощение АТФ, приводя к генотоксическому стрессу, который
активирует гены р21, CDKN1A и другие гены, ответственные за стресс [8]. При этом
гибель клеток происходит по классическому (с участием митохондрий) апоптозному
пути. Следует отметить, что кинетинрибозид ингибирует рост не только раковых
клеток человека, но и нормальных клеток, и этот эффект сильно зависит от типа
клеток. Однако нормальные клетки менее чувствительны к кинетинрибозиду, чем
малигнизированные аналоги.
В
последние годы кинетинрибозид изучается в качестве терапевтического агента для
терапии множественной миеломы [11], острого миелобластного лейкоза [12] и рака
прямой кишки [13]. Таким образом, кинетинрибозид играет важную роль при
индукции клеточной гибели у клеток различных типов опухолей и может
рассматриваться в качестве перспективного кандидата на статус
противоопухолевого средства.
Цель
настоящего исследования состояла в синтезе кинетинрибозида и проверке его
цитостатического действия на культуру опухолевой ткани человека.
Анализ цитотоксичности кинетинрибозида проводили с
помощью МТТ-теста по методике, описанной в [14] с небольшими модификациями. Монослойную клеточную культуру HeLa культивировали в среде RPMI, содержащей 10% эмбриональной телячьей сыворотки, 4
мМ L-глютамин, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина, при 37оС
во влажной атмосфере с 5% СО2. Клеточная культура поддерживалась на
стадии логарифмического роста путем рутинного субкультивирования трижды в
неделю. В каждую лунку 96-луночного планшета вносили 5000 клеток и инкубировали
24 ч при 37оС в темноте во влажной атмосфере c 5% СО2 для
адгезии клеток на дне лунки. Далее добавляли кинетинрибозид в концентрации от 1
мкM до 100 мкМ, растворенный в ДМСО (< 0,1%). После 72 ч инкубации при 37оС
в темноте во влажной атмосфере c 5% СО2 в каждую лунку планшета с
клеточной культурой вносили 20 мкл раствора МТТ (5 г/л) и инкубировали на
протяжении 4 ч при 37оС в темноте во влажной атмосфере c 5% СО2.
По окончании инкубации супернатант осторожно удаляли, а в каждую лунку
добавляли по 200 мкл ДМСО. Осадок ресуспендировали и инкубировали планшет 15
мин в темноте при комнатной температуре. Показания
оптической плотности считывали при длине волны 570 нм на планшетном ридере
АИФ-М/340 производства РУП «Витязь» (Беларусь).
Для синтеза кинетинрибозида бариевую соль α-D-рибозо-1-фосфата (донор рибозного остатка) инкубировали в Трис-HCl-буфере (рН 7,5) с эквимолярным количеством кинетина (акцептор рибозного остатка) и рекомбинантной
бактериальной пуриннуклеозидфосфорилазой. При этом под действием фермента
происходило замещение фосфата в молекуле α-D-рибозо-1-фосфата на кинетин с образованием
кинетинрибозида.
При хроматографировании на тонкослойных
пластинках "Silufol-UV254"
фирмы "Serva"
(Германия) в системе растворителей: хлороформ–этанол в соотношении 4:1 (об/об),
подвижность целевого продукта совпадала с Rf контрольного препарата кинетинрибозида
фирмы «Sigma» (США).
УФ-спектр: (рН 7), lмакс нм (e): 268 (19000); (рН 1), lмакс нм (e): 267 (18500); (рН 13), lмакс нм (e): 269 (19100).
Существенное отличие такого технического решения от известных
способов получения кинетинрибозида из кинетина и донора рибозного остатка (см.,
например, [15] состоит в том, что в реакционную смесь донор вносится в виде
бариевой соли этого органического фосфата. При этом фосфат, под действием
фермента вытесняемый кинетином из α-D-рибозо-1-фосфата, выпадает в осадок в
виде водонерастворимой бариевой соли. Это удаление из раствора неорганического
фосфата (который требуется пуриннуклеозидфосфорилазе для фосфоролиза
нуклеозидов) делает невозможным обратный процесс − фосфоролиз целевого
продукта. Таким образом, реакция синтеза целевого продукта становится необратимой,
что в результате приводит к практически 100%-ной трансформации исходного кинетина
в кинетинрибозид.
Следует подчеркнуть, что процедура выделения целевого продукта из
конечной реакционной смеси в предлагаемом техническом решении резко упрощается,
поскольку из продуктов реакции в конечном растворе находится практически только
кинетинрибозид, в отличие от реакционной смеси, получаемой согласно способу
[15], где кроме целевого продукта присутствуют остатки непрореагировавших
исходных субстратов, неорганический фосфат, а также α-D-рибозо-1-фосфат (промежуточный продукт) и
гуанин (побочный продукт).
Антипролиферативную активность
кинетинрибозида по отношению к клеточной линии аденокарциномы шейки матки (HeLa) оценивали с помощью МТТ-теста. Данный метод основан
на способности митохондриальных ферментов живых клеток восстанавливать
водорастворимую тетразолиевую соль МТТ (бромид
3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия) до формазана, который
кристаллизуется внутри клетки. Только живые клетки способны восстанавливать
желтый МТТ-субстрат в темно-синий формазан. Число жизнеспособных клеток прямо
пропорционально количеству восстанов-ленного формазана, которое можно
определить спектрофотометрически после его растворения в органическом
растворителе.
Зависимость,
характеризующая антипролиферативную активность полученного кинетинрибозида,
показана на рис. 1.
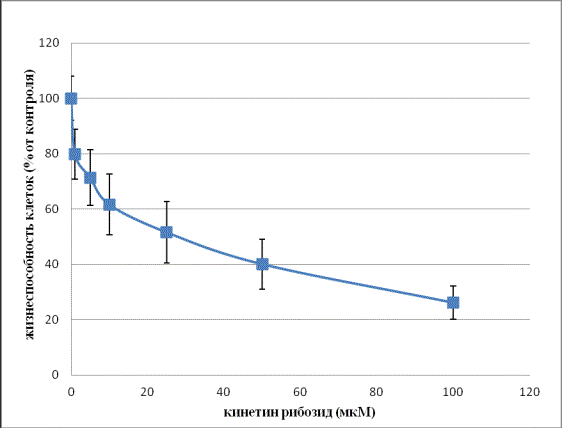
Рис. 1 – Ингибирующее действие различных концентраций
кинетин- рибозида на рост клеточной линии аденокарциномы шейки матки HeLa
Из рис. 1 видно, что кинетинрибозид оказывает достоверное антипролиферативное действие на клетки HeLa. Концентрация кинетинрибозида, которая вызывает 50%
гибель клеток (LC50), составляет 24,2 мкМ, что несколько превышает
показатель (5 мкМ), полученный ранее [10].
Литература:
1. Miller C.O., Skoog F., Von Saltza M.H.,
Strong F.M. Kinetin: a cell division factor from deoxyribonucleic acid // J.
Am. Chem. Soc. 1955. Vol. 77. P. 1392–1393.
2. Barciszewski J., Siboska G.E., Pedersen B.O. et al. Evidence for the
presence of kinetin in DNA and cell extracts // FEBS Lett. 1996.
Vol. 393. P. 197–200.
3. Ge L., Yong J.W.H., Goh N.K. et al. Identification of kinetin and kinetin riboside in coconut (Cocos nucifera L.) water using a
combined approach of liquid chromatographytandem mass spectrometry, high
performance liquid chromatography and capillary electrophoresis // J. Chromatogr.
B. 2005. Vol. 829. P. 26–34.
4. Yong J.W.H., Ge L., Ng Y.F., Tan S.N. The chemical composition and
biological properties of coconut (Cocos nucifera L.) water // Molecules. 2009. Vol. 14. P. 5144–5164.
5. Barciszewski J., Massino F., Clark B.F.C. Kinetin: a multiactive
molecule // Int. J. Biol. Macromol. 2007. Vol. 40. P. 182–192.
6. Orr M.F., McSwain B. The effect of kinetin,
kinetin ribofuranoside and gibberellic acid upon cultures of skin and mammary
carcinoma and cystic disease // Cancer Res. 1960. Vol. 20. P. 1362–1364.
7. Cheong J., Goh D., Yong J.W.H. et al. Inhibitory effect of kinetin
riboside in human heptamoa, HepG2 // Mol. BioSyst. 2009. Vol. 5. P. 91–98.
8. Cabello C.M.; Bair W.B., Ley S. et al. The experimental
chemotherapeutic N 6-furfuryladenosine (kinetin-riboside) induces rapid ATP
depletion, genotoxic stress, and CDKN1A (p21) upregulation in human cancer cell
lines // Biochem. Pharmacol. 2009. Vol. 77. P. 1125–1138.
9. Griffaut B., Bos R., Maurizis J.C. et al. Cytotoxic effects of
kinetin riboside on mouse, human and plant tumour cells // Int. J. Biol.
Macromol. 2004. Vol. 34. P. 271–275.
10. Choi B.H.; Kim W.; Wang Q.C. et al. Kinetin
riboside preferentially induces apoptosis by modulating Bcl-2 family proteins
and caspase-3 in cancer cells // Cancer Lett. 2008. Vol. 261. P. 37–45.
11. Tiedemann R.E., Mao X., Shi C.X. et al.
Identification of kinetin riboside as
a repressor of CCND1 and CCND2 with preclinical antimyeloma activity // J.
Clin. Invest. 2008. Vol. 118. P. 1750–1764.
12. McDermott
S.P., Eppert K., Notta F. et al. A small molecule screening strategy with validation
on human leukemia stem cells uncovers the therapeutic efficacy of kinetin
riboside // Blood. 2012.
Vol. 119, N 5. P. 1200−1207.
13. Rajabi M.,
Gorincioi E., Santaniello E. Antiproliferative activity of kinetin riboside on
HCT-15 colon cancer cell line // Nucleosides, Nucleotides, Nucleic Acids. 2012.
Vol. 31, N 6. P. 474–481.
14. Shim H.Y., Park J.H., Paik H.D. et al. Acacetin-induced apoptosis of human breast cancer MCF-7 cells involves
caspase cascade, mitochondria-mediated death signaling and SAPK/JNK1/2-c-Jun
activation // Mol. Cells. 2007. Vol. 24, N 1. P. 95–104.
15. Takeda Chem. Industries Ltd. /
Patent N 1063951 GB; 1967.