Биологические науки/ 9.Биохимия и биофизика.
Проф. Аужанова Н.Б., Сейтниязов Т.Т.
ЖГУ
им. И.Жансугурова,
СШ им.Г.Титова. Казахстан
Электрод внутри
клетки
Все знают что, исследования
жизненных процессов, происходящих в растениях, ведутся в наши дни самыми
современными средствами, и использование электрической аппаратуры в таких
исследованиях не редкость. Речь пойдёт об
электрических явлениях, возникающих в организме самого растения в процессе
жизнедеятельности.
Для изучения биоэлектрических явлений
используются по преимуществу клетки харовых водорослей (Charóphyceae). Если
измерить разность электрических потенциалов между вакуолью и наружной водной
средой, в которой живёт водоросль, окажется, что она составляет довольно
внушительную величину - 0,15 в, чтобы
ввести электрод внутрь клетки достаточно иметь микроскоп и микроманипулятор.
Нужно измерить разность электрических потенциалов между вакуолью и окружающее
средой, это значит, что один
электрод должны погрузить в наружный раствор, другой - в вакуоль, соединить его
через вольтметр и посмотреть, какую цифру покажет его стрелка.
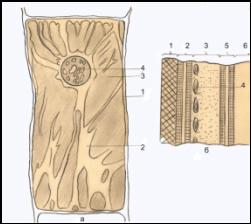
Как это сделать? Ввести внутрь клетки проволочку
нельзя: она будет в контакте и с наружным раствором, и с протоплазмой, проводник,
идущий внутрь клетки, должен быть от них надёжно изолирован и находится в
контакте только и именно с вакуолярной жидкостью - клеточным
соком. Стеклянную пипетку диаметром 1 мк заполнить раствором
электролита (хлористого
калия) и в толстую её часть
вводят кусок проволоки - получают
микроэлектрод, прекрасно удовлетворяющий требованиям измерений [1].

 Итак, погружая один
электрод в окружающий раствор, второй вводим внутрь клетки. Напряжение – 0,15 в.
Пусть
считается доказанным, что некие электрические явления могут наблюдаться на
уровне отдельной клетки. Но именно здесь возникает вопрос: а почему? Откуда
взялась
разность потенциалов между вакуолью и наружным раствором? Зная, что
электричество - это направленное
движение направленных частиц, катионов и анионов, сложно
предположить различный ионный состав наружной и внутренней среды. И
возникающая разность потенциалов объясняется именно различием 0,15 в.
перемещением ионов. Отметим, что стрелка вольтметра отклоняется
на 0,5
в.
в «минусовую»
сторону; это означает, что вакуоль заряжена отрицательно по отношению к наружной
среде. Значит у внутренней
поверхности анионов несколько больше, чем катионов, у наружной - меньше. Для того
чтобы получить столько уж раз упоминавшиеся напряжение 0,15 в., необходимо,
чтобы концентрация электролита в вакуоли почти в 1000 раз превосходило его
концентрацию в среде. Причина возникновения разности потенциалов в
биологических тканях
чрезвычайно проста - различие
концентраций электролитов.
Итак, погружая один
электрод в окружающий раствор, второй вводим внутрь клетки. Напряжение – 0,15 в.
Пусть
считается доказанным, что некие электрические явления могут наблюдаться на
уровне отдельной клетки. Но именно здесь возникает вопрос: а почему? Откуда
взялась
разность потенциалов между вакуолью и наружным раствором? Зная, что
электричество - это направленное
движение направленных частиц, катионов и анионов, сложно
предположить различный ионный состав наружной и внутренней среды. И
возникающая разность потенциалов объясняется именно различием 0,15 в.
перемещением ионов. Отметим, что стрелка вольтметра отклоняется
на 0,5
в.
в «минусовую»
сторону; это означает, что вакуоль заряжена отрицательно по отношению к наружной
среде. Значит у внутренней
поверхности анионов несколько больше, чем катионов, у наружной - меньше. Для того
чтобы получить столько уж раз упоминавшиеся напряжение 0,15 в., необходимо,
чтобы концентрация электролита в вакуоли почти в 1000 раз превосходило его
концентрацию в среде. Причина возникновения разности потенциалов в
биологических тканях
чрезвычайно проста - различие
концентраций электролитов.
Сам по себе напрашивается вопрос: играют ли
электрические явления в растениях физиологическую роль, или это просто побочная
(практически
неизбежное)
следствие неравномерного
распределения концентраций ионов? Можно ли с помощью измерения
электрических эффектoв
получить полезную информацию о тех или иных
процессах жизнедеятельыости?
Каким образом электрические характеристики клеток и тканей зависят от
внешних условий?
До сих пор мы говорили лишь об одном показателе
разности электрических потенциалов между вакуолью
и наружной средой (потенциал покоя), но как измерить
сопротивление клеточной мембраны? Приходится еще
больше усложнять и без того непростые микроэлектродные измерения.
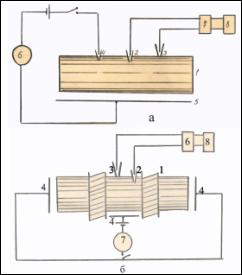
Внутрь клетки
вводится не один электрод, а два, причем один - примерно в середине
клетки, второй - на
определенном от него расстоянии, ближе к одному из концов вдоль клетки и параллельно ей
в наружном растворе размешается проводка. Теперь пропустим через первый
микроэлектрод и проводку импульс тока. При этом величина
разности электрических потенциалов, регистрируемая с помощью второго электрода
будет меняться
тем сильней, чем больше сопротивление клеточной
мембраны. Поскольку перенос тока через мембрану
осуществляется ионами, ее сопротивление тем выше, чем меньше проницаемость для
каждого сорта ионов и чем ниже их концентрация в окружающем растворе и
вакуолях. Опять сталкиваемся с необходимостью измерения
концентрации ионов в клеточном соке. Для измерений используются микроэлектроды
особой конструкции. Чувствительный кончик такого электрода изготовлен из особого стекла и запаен наглухо.

Стекло, используемое для изготовления кончика - ионоселективное, - обладает очень высокой
проницаемостью по отношению к какому-нибудь сорту ионов; и
практически непроницаемо для других ионов.
В основу измерений, выполняемых с помощью такого
электрода, положен эффект возникновения разности электрических потенциалов по обе стороны
полупроницаемой мембраны. Сначала экспериментально устанавливается зависимость
между величиной этого потенциала и концентрацией раствора, в который погружен
кончик электрода.
Ионоселективный электрод вводится в вакуоль, туда же вводится обычный микроэлектрод
и по показанию вольтметра с помощью построенной ранее
зависимости устанавливается внутриклеточная концентрация калия.
Точность этого метода ниже, но зато он гораздо производительнее, а
самое главное позволяет сохранить клетку жизнеспособной, пригодной для
дальнейших измерений [2].
Очень интересно исследовать зависимость
электрических явлений в клетке от концентрации ионов в вакуоли: более того,
внутренние концентрации будут при этом известны точно - ведь экспериментатор сам
может приготовить искусственный клеточный сок в пробирке, и добавлять
туда что угодно.


Эксперимент по замене содержимого вакуоли с
сохранением полной жизнеспособности клетки, в конце концов, тоже удался. В
клетку нителлы (Nitella flexilis), с торцов вводятся две стеклянные микроиглы.
По конструкции они в точности напоминают стекляный микроэлектрод, только
кончик у них значительно толще - 30 мк. Ткань
торцов клетки - почти
полностью омертвевшая, и механические повреждения, связаннее с введением
микроигл, клеткой практически не чувствуется. Вторая микроигла, в отличие от
первой, служит для токов оттока вакуолярной жидкости наружу. Но,
даже обладая столь совершенным инструментом, перфузию (прокачивание
искусственного раствора через клетку) осуществить не так-то
просто.
Дело в том, что клеточный сок в растительной клетке находится под значительным
давлением - около
8 атм.
Высокое внутриклеточное давление возникает из-за все той же разности
концентраций клеточного сока и наружной среды. Оказывается, что в семье растений - созданий скромных,
непритязательных и спокойных - есть отдельные
представители, с полным основанием называемые хищниками. Правда,
специализированных «электрохищников»
подобных знаменитому
электрическому скату и электрическому
угрю, поражающим свои жертвы сильным электрическим разрядом, в растительном
царстве нет. Однако, электрические явления, происходящие в организме
растений-хищников, имеют самое прямое отношение к их агрессивному поведению и
столь странному для растений образу жизни.
Литература:
1. Галактионов
С.Е.,
В.М.Юрин. Ботаники
с гальванометром. - М.: Знание, 1979.
2. Патури Ф. Растения гениальные
инженеры природы. - М.: Прогресс,
1979.