Актуальные
проблемы развития центра муковисцидоза Республики Татарстан
В.П. Булатов1, Н.В. Рылова1 ,
Д.С. Шагиахметова2, О.Г. Пятеркина2, Л.В. Храмова2
Казанский государственный медицинский университет
Детская республиканская клиническая больница МЗ РТ
Муковисцидоз (МВ) – системная
наследственная экзокринопатия, обусловленная мутацией гена, наследуемая по
аутосомно-рецессивному типу с неуклонно прогрессирующим течением. На сегодняшний день муковисцидоз является одним из наиболее
тяжелых наследственных хронических полиорганных заболеваний и составляет более 9-10%
от общего числа больных детского пульмонологического стационара. Проблема
своевременной диагностики муковисцидоза, раннего начала адекватной терапии,
активной реабилитации и социальной адаптации является актуальной не только
с медицинской точки зрения, но и важной в экономическом плане,
поскольку поздняя диагностика и лечение требуют больших затрат и раньше
приводят к инвалидизации ребенка.
Распространенность
муковисцидоза варьирует в зависимости от популяции. Наиболее часто МВ
встречается среди населения Северной Европы, Северной Америки и Австралии
(1:3500 новорожденных) [1, 2, 3]. В Медико-генетическом научном центре РАМН
были получены данные, свидетельствующие о более низкой частоте МВ в России
- 1:12000 новорожденных. Данный результат нельзя считать совершенно
неожиданным, одним из его объяснений может служить влияние смешения
славянских, тюркских, финно-угорских и других популяций в ходе
формирования населения России. Ежегодно в Москве рождается 10, в России
- 300, в США 2000, во
Франции, Англии, Германии – от 500 до 800, а в мире -
более 45000 детей, больных МВ.
Центр диагностики и лечения муковисцидоза Республики
Татарстан был организован в 1993 году на базе
пульмонологического отделения Детской республиканской клинической больницы
(ДРКБ) МЗ РТ. В настоящее время в центре наблюдаются и получают
лечение 73 пациента (56 - до 18
лет, 17 - старше 18 лет), 13 из
них взяты на учет после обследования по поводу положительного
неонатального скрининга. До введения неонатального скрининга муковисцидоз
диагностировался в поздние сроки (рис. 1).
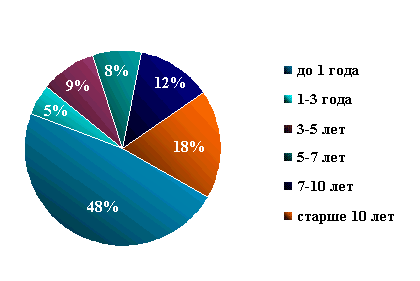
Рис.
1. Сроки установления диагноза МВ до введения неонатального скрининга
В соответствии с
постановлением Правительства Российской Федерации от 31.12.2005 г. № 870
и приказом МЗ и СР России от 22 марта 2006 года № 185
подготовлены стандарты оказания медицинской помощи детям с муковисцидозом
в амбулаторно-поликлинических и стационарных учреждениях. Неонатальный
скрининг на МВ у новорожденных основан на определении уровня
иммунореактивного трипсиногена (ИРТ), который выше у больных детей в 5-10 раз
за счет закупорки секреторных протоков поджелудочной железы. Метод
исследования: количественный флюоресцентный иммунный анализ. Частота неонатальной
гипертрипсиногенемии в популяции составляет 5-10 детей на 1000
новорожденных.
Программа неонатального скрининга [4, 5, 6]
включает в себя несколько этапов. Первый этап - в родильном доме на 3-5-й
день жизни у всех новорожденных производится взятие крови для исследования
и доставка ее в специализированную лабораторию.
Второй этап представляет собой
лабораторное исследование всех поступивших в лабораторию образцов крови
новорожденных. Если результаты в пределах нормы, то на этом
обследование завершается. В случаях превышения нормальных показателей,
родителям ребенка высылается письмо с просьбой обеспечить повторное,
уточняющее исследование крови малыша.
Третий этап при положительном результате (более 40 нг/мл) -
потовая проба. Четвертый этап при пограничном результате потовой пробы -
ДНК-диагностика.
В Республике
Татарстан с октября 2006 г. по декабрь 2009 г. обследовано 110556 новорожденных: в 2006 г.
– 8 396, 2007 г. – 40 400, 2008 г. – 40 240, 2009 г. - 21520. Неонатальная гипертрипсиногенемия (ИРТ >70 нг/мл)
выявлена у 716 детей. Один ребенок с положительным скринингом умер. Положительный
ретест (ИРТ >40 нг/мл) – 54 человек. Муковисцидоз подтвержден
у 13 пациентов. У
одного ребенка с нормальными цифрами ИРТ выставлен диагноз МВ. Генетическое
исследование – ДНК-диагностика проведена 5 больным, выявлена мутация DelF508 в гетерозиготном состоянии. Распространенность
муковисцидоза в РТ составила 1:8000 новорожденных. Средний возраст
больных центра МВ РТ достиг 16 лет, а медиана выживаемости составила 19,6 лет
(рис. 2).
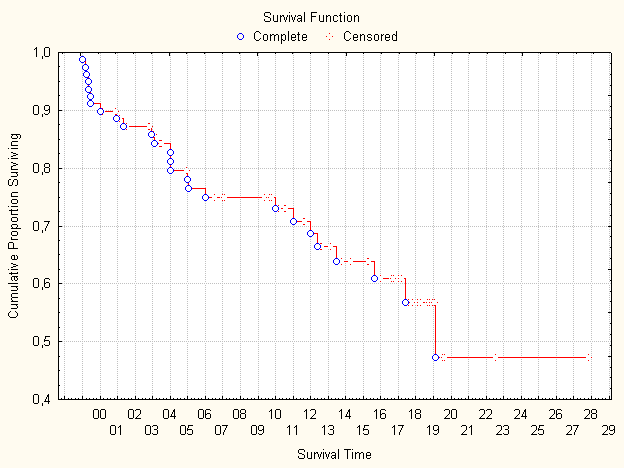 Рис. 2. График выживаемости пациентов центра
МВ РТ.
Рис. 2. График выживаемости пациентов центра
МВ РТ.
В центре успешно применяются две системы для анализа проводимости пота.
Система для сбора и анализа пота Маcroduct в комплексе с потовым
анализатором Sweat-Chek (США) позволяет проводить потовую пробу вне
лаборатории; время сбора пота составляет 30 минут и успешно применяется у детей
первых месяцев жизни. Специально для обследования новорожденных применяется
аппарат Nanoduct, объединяющий систему для стимуляции потоотделения путем
электрофореза 0,1%-ного пилокарпина и анализатор проводимости пота.
Благодаря минимальному количеству необходимой для теста потовой жидкости (всего
3–6 мкл) этот аппарат незаменим при обследовании новорожденных в рамках
массового скрининга.
Среди пациентов центра МВ РТ доля тюркской и славянской этнических
групп составляет 57% и 32% соответственно (11% - смешанная группа). Доминирующей
мутацией во всех народностях является delF508 - 53% пациентов. При
этом в 40% случаев мутация delF508 выявлена в гомозиготном состоянии,
в 6% - гетерозиготном положении с другой идентифицированной мутацией
(delF508/2141delT, delF508/N 1303), а в 7% – гетерозиготном положении с неизвестной
мутацией (delF508/unknown). Другие мутации гена CFTR (del121kb, 2143delТ)
встречаются редко - идентифицированы у 10% пациентов. Генотип не идентифицирован у 37 % пациентов, которые относятся к тюркской этнической группе.
Установлено, что мутация delF508
ассоциируется с тяжелым течением
заболевания, возникновением серьезных осложнений со стороны гепатобилиарной системы, поджелудочной железы,
в то время как
остальные мутации более редко приводят к подобным осложнениям. В данной группе больных
выявлены такие патологические состояния, как цирроз печени, портальная
гипертензия, сопровождающаяся кровотечениями из верхнего отдела
пищеварительного тракта, асцитом, гиперспленизмом. В ряде случаев
развивается желчнокаменная болезнь (4%). Изменения в поджелудочной
железе ведут к возникновению сахарного диабета (6%).
При диагностике заболевания у первичного
больного помимо общепринятых методов обследования (ультразвуковая и рентгенологическая
диагностика, исследование степени стеатореи, функций внешнего дыхания и т.д.)
используется компьютерная томография (РКТ)
органов грудной клетки, позволяющая выявить наличие, локализацию,
распространенность бронхоэктазов, пневмосклероза, субсегментарные ателектазы, в то время
как на рентгенограммах те же патологические изменения не
визуализируются. В ДРКБ компьютерная томография
проводится с 1995 года на аппарате фирмы "Toshiba" X-SPEED. Критериями отбора детей для направления на РКТ являются
следующие рентгенологические данные -диффузная грубая деформация легочного
рисунка, сегментарные или долевые затенения легочной ткани, участки уплотнения
легочной ткани, ателектатические изменения, смещение средостения, а также
необъяснимые респираторные симптомы. При проведении РКТ пациентам
до 3 лет применялась программа с толщиной среза 5 мм, шагом
5 мм, а у детей старшего возраста - с толщиной среза 10 мм,
шагом 10 мм. При обследовании оценивается состояние бронхиального дерева и окружающей
легочной паренхимы. Наиболее часто встречающимися проявлениями хронического
бронхолегочного процесса были: утолщение стенок бронхов и их деформация,
перибронхиальная инфильтрация, диффузные фиброзные изменения легочной ткани и бронхоэктазы.
При наличии небольших булл с утолщенными стенками удается дифференцировать
их с кистозными бронхоэктазами. Кроме того, рентгеновская компьютерная
томография позволяет лучше оценить состояние легкого. Специальная подготовка не требуется,
за исключением детей раннего возраста, которым исследование проводится под
премедикацией или кратковременным наркозом. Ценность данного метода также обусловлена возможностью оценки
прогрессирования бронхолегочного процесса и эффективности лечения.
Проводимое бактериологическое исследование
мокроты указывает на преобладание ассоциации Ps. Aeruginosa et St. Aureus. У четверых больных отмечается высев MRSA, что вызывает
наибольшие сложности в проведении
антибактериальной терапии. Изоляты P.aeruginosa были чувствительны к карбопенемам
(меропенем, имипенем), фторхинолонам (ципрофлоксацин), цефтазидиму. Заметно
меньшую антисинегнойную активность проявляли амикацин, цефиксим. Все
стафилококки были чувствительны к ванкомицину, а MSSA также
чувствительны к цефалоспоринам I, II, III поколения
(цефазолин, цефуроксим, цефепим), зашишенным пенициллинам (амоксиклав),
макролидам (азитромицин, кларитромицин). В зависимости от результатов
бактериологического мониторинга мокроты больным разрабатывается индивидуальная антибактериальная
терапия. Часть детей получают ее плановыми, двухнедельными внутривенными курсами каждые
3-4 месяца, что позволяет снизить частоту обострений бронхолегочного
процесса в 2 раза. Кроме того, успешно применяются пероральные и ингаляционные пути введения антибактериальных средств.
В 2000 году
на базе пульмонологического отделения ДРКБ начато применение
муколитического препарата - пульмозим (фирма «Хоффманн - Ля Рош»). Пульмозим
представляет собой рекомбинантную человеческую ДНКазу, является синтезированным
ферментом, аналогом природного фермента человека. Пульмозим применяется в виде ингаляций
через небулайзер в дозе 2,5 мг в день. Имеется опыт применения
пульмозима у детей раннего возраста - первого года жизни (3 детей
старше 3‑х мес.) при отсутствии эффекта от амброгексала, лазолвана и
т.д.
На фоне лечения пульмозимом у всех больных наблюдалось улучшение, как
самочувствия, так и реологических свойств мокроты. Показатели функции внешнего
дыхания (рис. 3) и сатурации кислорода также имели положительную
динамику. Побочные эффекты за период применения препарата установлены у 2
пациентов - в виде осиплости голоса.
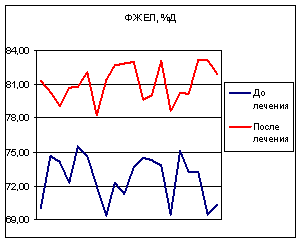
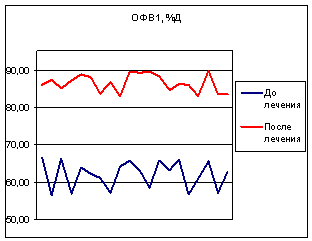
Рис. 3. Показатели функции внешнего дыхания пациентов до и после
лечения
Все пациенты центра МВ РТ обеспечиваются
креоном, муколитиками (ацетилцистеин, амброксола гидрохлорид и др.),
гепатопротективные препараты (хенофальк, урсофальк, урсосан) по бесплатным
рецептам. 100% больных муковисцидозом обеспечены компрессорными
ингаляторами различных фирм (PARI, OMRON) и получают ежедневные ингаляции с бронхолитиками
(беротек, беродуал), муколитками (пульмозим, ацетилцистеин, амброгексал), по мере
необходимости – антибиотиками. С 2009 года в лечении пациентов используется
перкуссионный интрапульмональный вентилятор.
Одним из наиболее важных компонентов
терапии муковисцидоза является кинезитерапия, которая во многом определяет
длительность и качество жизни больного. Применяются дыхательные игры,
упражнения для грудной клетки и живота, дренажные положения тела,
клопф-массаж, аутогенный дренаж, флаттер, упражнения на гимнастических
мячах, батутах.
Учитывая необходимость постоянного контроля состояния наблюдаемых больных, проводится регулярное контрольное обследование (1 раз в 3-6 месяцев), с последующей коррекцией базисной терапии. Как результат комплексной и современной терапии отмечается снижение частоты обострений бронхо-легочного процесса, летальности. Совершенствующиеся лечебные и медико-социальные мероприятия благоприятно влияют на продолжительность жизни пациентов.
В последние годы значительно
изменилось понимание проблемы муковисцидоза, как медицинскими работниками, так
и организаторами здравоохранения. Создана ассоциация родителей больных
детей, которая совместно с Российским центром муковисцидоза проводит
просветительскую, психологическую, правовую работу по проблемам заболевания.
Акцентируется важность участия родителей в процессе лечения,
реабилитации, адаптации к современным условиям жизни больных детей. Однако, несмотря на очевидные
успехи, достигнутые в диагностике, лечении, реабилитации и медико-социальной
адаптации больных муковисцидозом, остается немало вопросов, требующих дальнейшего
решения.
Литература:
1. Ratjen F, Doring G. Cystic fibrosis. Lancet 2003;361:681–9.
2. European journal of human genetics (2007) 15, 255–259.
doi:10.1038/sj.ejhg.5201749; published online 20 December 2006.
3. Patient registry
2003 annual report. Bethesda, Md: Cystic Fibrosis Foundation. 2004.
4. Толстая В.Д.,
Каширская Н.Ю., Капранов Н.И. Массовый скрининг новорожденных на муковисцидоз в
России. Фарматека, Москва. 2008. (№1): 38-43.
5.
Каширская Н.Ю., Капранов
Н.И., Толстая В.Д. Перспектива ранней диагностики и адекватного лечения детей,
больных муковисцидозом РФ. Пульмонология Том 16. 2008. (№6): 405-408
6.
Каширская Н.Ю., Капранов
Н.И., Толстая В.Д. Муковисцидоз-национальная приоритетная программа в РФ. ГУ
«Медико-генетический научный центр РАМН». Москва. 2007.