upiter@rusnauka.com
д.т.н.
Федоров Б.С., к.х.н. Фадеев М.А., с.н.с. Козуб Г.И., д.б.н
Коновалова
Н.П., д.б.н. Татьяненко Л.В., к.х.н. Ларюкова М.В.
Институт
проблем химической физики РАН, Россия
Разработка антиметастатических и противоопухолевых лекарственных средств
на основе биогенных соединений – доноров NO.
В современной клинической практике при лечении
злокачественных опухолей широко используются комплексные соединения
двухвалентной платины (цис-платин или карбоплатин) или их комбинации с другими
цитостатиками. Существенным недостатком этих препаратов является высокая
токсичность (например для цисплатина и карбоплатина LD50
составляет 12,5 и 36 мг/кг соответственно) и узкий интервал терапевтических
доз, что ограничивает возможности их практического применения. Другим
недостатком современных противоопухолевых препаратов является их низкая
селективность действия. Анализ литературных данных показывает, что попытки
модификации цис-платина с целью повышения
эффективности, снижения его токсичности и повышения растворимости в воде
уже предпринимались ранее. При этом стремились получить новые комплексные
соединения Pt(II), имеющие цис-строение, которые, согласно правилу SAR-11 (связь активности со строением), имеют
более высокую противоопухолевую активность
в сравнении с комплексами транс-строения. С этой целью в качестве
лигандов использовали этилендиамин,
триметилендиамаин, незамещенный пиридин и ряд других лигандов, которые сами по
себе являются высокотоксичными соединениями. Не удивительно, что полученные на
их основе металлокомплексы также проявляют высокую токсичность, и, по-видимому,
это является одной из причин почему эти
соединения двухвалентной платины не нашли практического применения.
В настоящей работе в качестве лигандов были выбраны
биогенные малотоксичные соединения, а именно: никотиновая и изоникотиновая
кислоты, которые широко используются на практике для получения на их основе
ряда лекарственных средств: никотинамида (витамина РР), диэтилникотинамида (кордиамин используется для лечения
аритмии), изоникотингидразида (противотуберкулезное средство изониазид) и
некоторые другие. Выбор никотиновой и изоникотиновой кислот неслучаен, т.к. пиридиновый атом азота легко образует
прочные комплексы с платиной, а карбоксильные группы позволяют осуществить их
структурную модификацию с помощью этаноламинных, диэтаноламинных,
триметилоламинометановых и ряда других группировок. В том числе группировок,
способных при биотрансформации генерировать монооксид азота. В результате такой
модификации мы рассчитывали получить комплексные соединения, которые
различались бы по растворимости в воде, и мембранотропности. Нитратную, нитро-,
и динитрометильные группировки мы вводили с целью изучения влияния монооксида
азота, образующегося в процессе биотрансформации в организме, на
противоопухолевую и антиметастатическую активность комплексов Pt(II) и Pt(IV). Как
известно биологическое действие монооксида азота обусловлено активацией системы
циклических нуклеотидов, определяющих функциональную активность различных органов
и тканей, а также способных корректировать иммунитет. Первоначально нами были
синтезированы комплексы Pt(II) и Pd(II) c
вышеперечисленными лигандами. Эти комплексы по данным лаборатории
экспериментальной химиотерапии опухолей обладают малой токсичностью (от 250 до
750 мг/кг). Однако данные комплексы оказались не растворимыми в воде, что
затрудняет работу с ними на
биообъектах. В этой связи нами были синтезированы комплексные соединения с
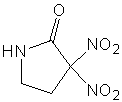
данными лигандами на основе четырехвалентной платины (Рис.1).
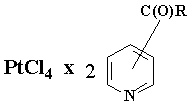
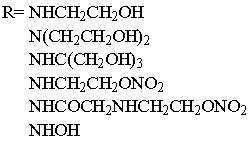
Рис.
1. Комплексные соединения на основе замещенных амидов никотиновой и
изоникотиновой кислот и тетрахлорида платины.
При этом методом РСИ было показано, что все
синтезированные нами комплексы на основе замещенных амидов никотиновой и
изоникотиновой кислот и тетрахлорида платины имеют цис-строение. Что касается
палладиевых комплексов, то здесь картина несколько иная: Производные
никотиновой кислоты образуют комплексы транс-строения, изоникотиновой –
цис-строение, что хорошо видно на примере реакции 2-нитроксиэтилникотината – и
2-нитроксиэтилизоникотинамида с дихлоридом палладия.
Так N-(2-нитроксиэтил)никотинат
образует в реакции с дихлоридом палладия комплекс транс-строения. В то же время
2-нитроксиэтилизоникотинат с дихлоридом палладия образует комплекс
цис-строения. В реакцию комплексообразования можно вводить и смесь лигандов,
если их реакционные способности по отношению к металлу – акцептору близки. Так
комплекс Pt(II) с двумя изомерными лигандами имеет транс-строение. Синтезирован
также комплекс дихлорида палладия в котором один из лигандов содержит нитратную
группу, а другой – гидроксильную. Экспериментально на примере синтеза
комплексов замещенных амидов никотиновой и изоникотиновой кислоты и
тетрахлорида платины установлено, что направление реакции комплексообразования
с дихлоридими палладия и платины зависит от местоположения нитроксиэтиламидной группировки в
пиридиновом кольце лиганда. Так, производные никотиновой и изоникотиновой
кислот, при заместителях в 3 и 4 положениях дают комплексы с атомом азота
пиридинового кольца, при этом нитроксиэтиламидные группировки остаются
неизменными. В отличие от этого реакция дихлоридов палладия и платины с
изомерными лигандами, содержащими нитроксиэтильные группировки в положениях 2 и
6 пиридинового кольца, протекает более сложно, а именно, с элиминированием
нитратной группы и с последующим замыканием в оксазолиновый цикл.
Синтезированные соединения были проверены в
лаборатории экспериментальной химиотерапии опухолей ИПХФ РАН на
антиметастатическую и противоопухолевую активность. Было показано, что все
металлокомплексы на основе замещенных амидов пиридинкарбоновых кислот и
тетрахлорида платины ингибируют процесс метастазирования при экспериментальной
меланоме В-16 и карциноме легких Льюис на 93-96%. Такой же высокий эффект
наблюдали при пероральном введении препаратов. Меланому В-16 и карциному легких
Льюис трансплантировали под кожу бока мышей – гибридов BDF1.
Инокулум опухолевых клеток для карциномы легких Льюис составлял 106,
а для меланомы В-16 - 5×106 опухолевых клеток. Препараты
вводили внутрибрюшинно или перрорально.
В то же время для комплекса дихлорида палладия с N-никотиноил-N-(2-нитроксиэтил)
аминопропионовой кислоты обнаружена противоопухолевая активность на карциноме 755
и низкая острая токсичность (ЛД50 = 1000 мг/кг). Таким образом, этим
примером впервые подтверждена наша гипотеза о том, что в принципе возможен
синтез противоопухолевого препарата с пониженной токсичностью.
Полученные результаты позволяют сформулировать
обобщенный подход к созданию новых комплексов дихлорида палладия и тетрахлорида
платины с биогенными лигандами, например, из группы замещенных пиперидинов.
Так в соответствии с предложенным нами
подходом получен комплекс 4-амино-2,2,6,6-тетраметилпиперидина с тетрахлоридом
платины, который при низкой токсичности (ЛД50=370 мг/кг) ингибирует
процесс метастазирования при экспериментальной меланоме В-16 на 96 %. Этот
комплекс согласно РСИ имеет цис-строение, поэтому, по-видимому, и обладает
такой высокой терапевтической активностью, что лишний раз подтверждает правило SAR-1- (связь активности со строением).
Следует обратить внимание на то обстоятельство, что
практически все синтезированные нами комплексные соединения обладают высокой
антиметастатической активностью и лишь два из них проявили противоопухолевую
активность на меланоме В-6. Один из них цис-(бис-N-(2-нитроксиэтил)изоникотинамид - N]тетрахлорид платины (IV) тормозит рост меланомы В-16 на 83 % и ингибирует
рост метастазов на 96 %(Рис.2).
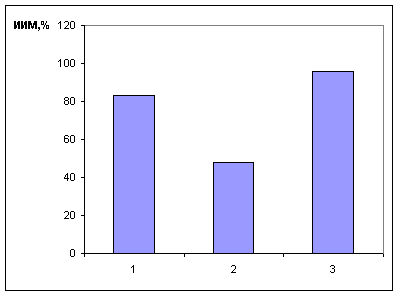
Рис 2. Адьювантное
действие нитроксиэтиламида изоникотиновой кислоты
в сочетании с цис-платином при торможении метастазов
меланомы В-16
1- Цис-Pt , 18x10-6M;
2- ИНК, 5,5x10-6M;
3- Цис-Pt ( 18x10-6M) + ИНК (5,5x10-6M).
Изучение молекулярных механизмов действия на ферментативной системе показало, что
синтезированные нами комплексы действуют на Са2+-Mg2+-зависимую
АТФ-азу саркоплазматического ретикулума и тормозят транспорт ионов Са2+
через биологические мембраны. В результате нарушается нормальное соотношение
ионов кальция на вне- и внутриклеточной поверхностях мембраны с последующим
нарушением агрегации тромбоцитов (важнейшего звена в процессе метастазирования)
и их связывания с метастатическими клетками, что способствует прекращению
адгезии последних к стенкам сосудов. Однако, синтезированные нами комплексные
соединения оказались мало растворимыми в воде, что затрудняет работу с
ними на биообъектах. В этой связи мы
остановили свое внимание на использовании лигандов в качестве адъювантных
средств в комплексной цитостатической терапии в сочетании с уже известными
цис-платином или циклофосфамидом. На эксперименте оказалось, что соединения из
класса нитратов спиртов, и гидроксамовых кислот проявляют терапевтическую
активность в цитостатической комбинированной терапии при лейкемии Р-388. В
частности использование комбинации циклофосфамида с оксиамидом аспарагиновой
кислоты (ОААК) (так называемая гидроксамовая кислота) позволяет выжить 50%
животных (Рис. 3.).
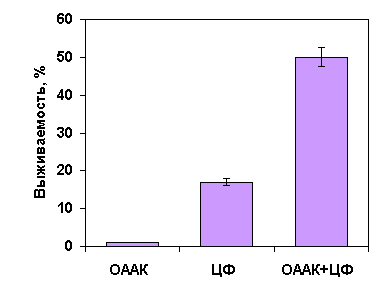
Рис 3. Процент выживших животных при терапии лейкемии P-388 с помощью оксиамида аспарагиновой кислоты (ОААК)
в сочетании с циклофосфамидом.
При этом увеличение средней продолжительности жизни
оставшихся 50% животных составляет 350% по сравнению с животными в контрольной
группе. Использование комбинации цисплатина
с оксиамидом аспарагиновой кислоты позволяет выжить 75% животных, а увеличение
средней продолжительности жизни оставшихся 25% животных составляет 500%. В тоже
время использование в цитостатической комбинированной терапии N-(2-нитроксиэтил)изоникотинамида в сочетании с
цисплатином позволило выжить 100% животных при лейкемии Р-388. Наконец,
использование в комбинированной цитостатической терапии оксиамида малеиновой
кислоты (ОАМК) позволяет также выжить 100% животных в опытной группе ( Рис.4).
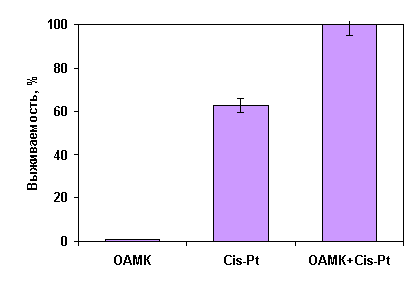
Рис 4. Хемосенсибилизирующий эффект оксиамида
малеиновой кислоты (ОАМК) при комбинированной терапии (лейкемия P-388).
В таблице 1 показано, что использование таких
нитросоединений как триметилолнитрометана, динитропропиламина, лактама
5,5-динитро-2-азапентановой кислоты позволяет получить достаточно высокий
терапевтический эффект (индексы ингибирования метастазов составляют при
экспериментальной меланоме В-16 63-68%) (табл. 1.).
Таблица 1. Антиметастатическая активность некоторых
нитросоединений (меланома В-16, LL-карцинома)
|
№ |
Формула |
LD50, мг/кг |
ИИМ,% |
|
|
Меланома В-16 |
LL-карцинома |
|||
|
1 |
O2NC(CH2OH)3 |
не токсичен в дозе 1000 |
63 |
- |
|
2 |
HOCH2C(NO2)2CH2OH |
375 |
- |
60 |
|
3 |
CH(NO2)2CH2CH2NH2 |
94 |
59 |
- |
|
4 |
|
75 |
68 |
- |
Экспериментально установлено, что наилучшими носителями
функциональных группировок - доноров NO
являются пиридин и пиперидин, а наилучшими донорами NO - динитрометильная группа. Таким образом,
подтверждена концепция синтеза противоопухолевых и антиметастатических
препаратов, изложенная нами ранее в работах [4 и 5], основная идея которой заключается в использование биогенных соединений в
качестве носителей функциональных группировок, в том числе группировок,
способных при биотрансформации генерировать NO.
Литература.
1.
A.Sigel and H.Sigel, Metal Jons in biological Systems, Marsel Dekker, Inc. New.York,1996.
2.
Б.С.Федоров,
М.А.Фадеев, Н.П.Коновалова, С.М.Алдошин, Т.Е.Сашенкова, М.В. Ларюкова. Патент РФ № 2295517. 1.
3. Л.В.Татьяненко, Н.Н.Коновалова, Г.Н.Богданов, Б.С.Федоров, Биомедицинская химия,2006,52,[Biomed.Chem.(Moskov)
(Engl.Transl.)2006].
4.
Б.С.Федоров, Н.И. Головина, М.А.Фадеев, А.Б.Еремеев, В.В.Аракчеева, Г.В.Струков, В.В.Кедров, Г.В.Шилов, Р.Ф.Трофимова, Л.О.Атовмян. Изв.АН Сер химическая, 1998,с527[Rus.Chem. Bull.
48,1584, (1999) Engl.Transl.)].
5.
Б.С.Федоров, Н.И.Головина, М.А.Фадеев, Г.В.Струков, В.В.Кедров, Г.В.Шилов, Г.Н.Бойко, Л. О.Атовмян. Изв АН Серия химическая, 2001, 499.[Rus.Chem. Bull.,50. 520(2001)(Engl.Transl.)].