Сичікова Я.О.
Бердянський державний педагогічний університет
Електронна структура та
анізотропія фосфіду індію
Властивості напівпровідникових та металевих
матеріалів можна дослідити, розглянувши електронну структуру цих матеріалів. Із
зонної моделі прямо випливає картина атомних рівнів енергії. Коли мова йде про
напівпровідники, обговорюються два типи зарядів – дірки та електрони. У
результаті струм в напівпровідниках складається з двох компонентів:
- рухливих дірок у валентній зоні;
- рухливих електронів у зоні провідності.
Електрони можуть бути збуджені у зоні провідності
електрично, термічно або оптично. Однак є ще один метод для генерації носіїв
заряду в напівпровідниках – легування кристалів. Легування постає у додаванні
різних хімічних елементів у напівпровідник. Найпростішим випадком є введення
елементів п’ятої групи (донорів) або третьої групи (акцепторів).
Нелеговані напівпровідники відомі як власні, а
леговані – домішкові. Леговані напівпровідники, у яких домінуючими носіями
заряду є електрони, називають n-типу, якщо носієм
заряду є дірка – р-типу. Для n-типу рівень Фермі лежить трохи нижче зони провідності, для р-типу – трохи вишче валентної зони. В
залежності від рівня легування напівпровідників рівень Фермі може бути
розташованим в забороненій зоні, або у валентній чи зоні провідності. Крім
того, під час травлення кристалу рівень Фермі залежить від виду електроліту,
він змінюється при прикладенні зовнішнього потенціалу.
Для отримання кристалів
з регульованими електрофізичними властивостями застосовують легування фосфіду
індію електрично активними домішками. S, Se, Te, Si, Ge, Sn застосовують для
отримання монокристаллов n-типу, Zn и Cd – відповідно р-типу. Фосфід індію
кристалізується у гратці типу сфалериту (рис. 1).
Структура
типу сфалериту відноситься до гексатетраедричного класу кубічної сингонії. У фосфіді
індію атоми фосфору займають вузли ГЦК-комірки, а атоми індію – центри чотирьох
октантів. Таку структуру можна описати як дві ГЦК-гратки, що зміщені одна
відносно другої на чверть діагоналі кубічної гратки. Атоми фосфору та індію
знаходяться у взаємозаміщуємих положеннях та утворюють дві правильні системи
точок, кожна має кратність 4. У структурі сфалериту ряд кристалографічних
площин є полярним. Поверхні А (In) та В (Р)
характеризуються відмінними поверхневими хімічними зв’язками. Це все зумовлює
анізотропію властивостей кристалу фосфіду індію.
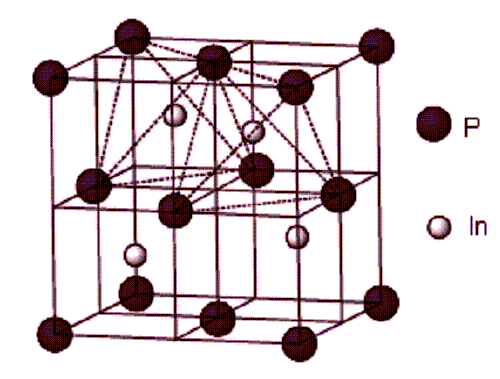
Рис. 1. Гратка фосфіду
індію
Анізотропія
фосфіду індію проявляється не лише у загальних фізичних властивостях, а й при
травленні кристалу. Анізотропне
травлення має велике значення для структурування напівпровідників і, в основному, пов'язано з відмінностями у швидкості травлення низькоіндексованих поверхонь кристалів. Причини такої поведінки ще не
повністю зрозумілі. Як
правило, досліджуються низькоіндексовані поверхні кристалу – це орієнтації
(111), (100), (110). Кожний набір площин має свою відмінну поведінку в розчині.
Однією з причин для визначення
відмінності різних кристалографічних площин може бути
щільність атомів
у цих кристалографічних
площинах (висока щільність = низька
швидкість розчинення). Однак, це –
не єдиний чинник, що визначає анізотропію. У з'єднаннях III-V
існує ряд додаткових
факторів, що сприяють анізотропії, це пов'язано з різними
хімічними властивостями атомів з третьої і п'ятої груп періодичної таблиці елементів. Наприклад, уздовж поверхні з орієнтацією <111>, атомні площини зайняті атомами з третьої і п'ятої груп, що утворюють подвійні шари, тобто існують
малі і великі
проміжки між площинами {111}, що чергуються. Кожен атом має
3 зв'язки в межах
одного подвійного шару і один
зв'язок поза подвійного шару. Поверхні, обмежені
атомами In називаються {111А}, тоді як
обмежені атомами
P - {111}
B. Важливо відзначити, що майже
в усіх окислювальних
процесах поверхні типу {111} мають більш
повільну швидкість
розчинення. Це можна пояснити в припущенні,
що три зв'язку
(в межах того ж
подвійного шару) набагато важче порушити з боку А, ніж
з боку В, у
зв'язку з
тим, що електронна
хмара одного зв'язку поляризована в напрямку
B атома (більше електронегативного).