Биологические науки / 3.Микология и альгология
(аспирант) Иванова И.Е,
(д.б.н.) Громовых Т.И.
Московский
государственный университет пищевых производств
Влияние внешних факторов на рост и
морфологию штаммов Laetiporus conifericola
Базидиомицеты являются источниками биологически
активных соединений, имеющих значение для пищевой и фармацевтической промышленности.
Особое значение имеют представители рода Laetiporus, паразитирующие на лиственных и хвойных породах
деревьев. В научной литературе накоплено достаточно много сведений о
биохимическом составе плодовых тел и мицелия представителей вида Laetiporus sulphureus.
В их состав входят незаменимые аминокислоты, каротиноиды, полисахариды [1,2],
которые обладают антиоксидантной, антимикробной [3] и противоопухолевой [4]
активностью. Штаммы вида Laetiporus sulphureus имеют особенно большое
значение как продуценты каротиноидных пигментов [5]. Все эти сведения относятся
к штаммам, выделенным как паразитов лиственных пород. В настоящее время
представители рода Laetiporus,
паразитирующие на хвойных породах, относят к новому виду Laetiporus conifericola [6]. Сведения по оценке
биохимического состава плодовых тел и мицелия штаммов этого вида отсутствуют.
Однако для биотехнологии новые штаммы Laetiporus conifericola могут представлять
практический и научный интерес для получения каротиноидов и ценной биомассы.
Как известно, при культивировании базидиомицетов
на их жизненный цикл, характер роста, накопление различных веществ и биосинтез пигментов
оказывают влияние состав питательной среды и внешние факторы, такие как
температура, свет, рН влажность. В связи с этим, необходимо было изучить влияние
внешних факторов среды на рост, развитие и биосинтез каротиноидных пигментов штаммов
Laetiporus conifericola.
Исследования проводили со штаммами
гриба Laetiporus conifericola MZ-
22, Ls 1-0 (штаммы вида Laetiporus conifericola депонированы как штаммы вида
Laetiporus sulphureus), Ls C-Q, выделенными из плодовых тел пораженных
древостоев лиственницы сибирской. На первом этапе исследований подбирали
оптимальную агаризованную питательную среду. Штаммы культивировали на следующих
средах: капустный агар, крахмало – аммиачный агар, дрожжевой агар, мальтс –
агар, среда сабуро. Динамика роста на средах показала, что наилучшая из них- капустный
агар. Среднесуточная скорость роста на ней
варьировала от 5,42 до 9,02 мм/сут., минимальная скорость была на крахмало-аммиачной среде 0,5–6,77 мм/сут. По показателям ростового коэффициента (таблица 1) капустный агар можно аналогично
считать наиболее благоприятной средой
по сравнению с другими, приведенными выше, ростовой коэффициент на
которых был ниже 200.
Таблица
1– Показатели роста штаммов Laetiporus conifericola на модифицированной капустной среде
|
Штамм |
Среднесуточная скорость роста на
питательной среде капустный агар с добавлением различных компонентов
(мм/сут) Ростовой коэффициент* |
|||
|
Капустный агар без добавок |
опилки |
соевая мука |
молочная сыворотка |
|
|
Ls 1-06 |
6,02±0,09 |
7,21±0,36 |
4,49±0,12 |
5,61±0,24 |
|
64 |
61,2 |
72 |
130 |
|
|
MZ-22 |
9,02±0,07 |
10,63±0,27 |
11,22±0,27 |
11,09±0,16 |
|
215 |
187 |
234 |
281 |
|
|
Ls C-Q |
8,20±0,14 |
9,10±0,16 |
8,44±0,07 |
8,56±0,15 |
|
114 |
76 |
144 |
182 |
|
|
*- Ростовой коэффициент измеряли, на 8- е сутки культивирования |
||||
Для повышения
ростовых показателей штаммов Laetiporus conifericola проводили модификацию капустной среды
путем добавления различных составляющих в количестве 1%: лиственничные опилки,
соевая мука «сопролекс» и молочная сыворотка. Результаты исследований показали,
что добавление в среду лиственничных
опилок в питательную среду увеличивало скорость роста, однако снижало ростовой
коэффициент, т.к мицелий формировался очень рыхлый (таблица 1).Следует отметить, что для штаммов MZ-22 и Ls C-Q скорость роста на средах с добавлением
соевой муки и молочной сыворотки была одинаковой к концу срока культивирования.
Как видно из таблицы, самый высокий ростовой коэффициент, для
всех штаммов отмечен на среде, содержащей молочную сыворотку (от 182 до 281).
Таблица 2 - Показатели роста штаммов Laetiporus conifericola при различных значениях температуры
|
Штамм |
Среднесуточная скорость роста при
различных значениях температуры / Ростовой коэффициент* |
||||
|
16 °С |
20 °С |
24 °С |
28 °С |
32 °С |
|
|
Ls 1-06 |
4,86±0,22 |
6,44±0,33 |
6,50±0,03 |
6,02±0,09 |
5,2±0,03 |
|
21 |
24 |
93 |
64 |
39,7 |
|
|
MZ-22 |
6,29±0,24 |
7,52±0,53 |
10,1±0,05 |
9,02±0,07 |
9,0±0,56 |
|
82,5 |
93 |
215 |
215 |
171 |
|
|
Ls C-Q |
5,24±0,44 |
6,72±0,45 |
8,51±0,05 |
8,20±0,14 |
7,55±0,15 |
|
18,7 |
54 |
140 |
114 |
57 |
|
|
*- Ростовой коэффициент измеряли,
на 8- е сутки культивирования |
|||||
При изучении влияния температуры на культивирование штаммов
Laetiporusconifericola было установлено, что наиболее
оптимальная температура 24 ºС (таблица 2). Среднесуточная скорость и
коэффициент роста уменьшались как при температуре ниже, так и выше значения 24
ºС.
Следует отметить, что для штаммов MZ-22 и Ls С-Q, не
смотря на увеличение среднесуточной
скорости роста, максимальный диаметр колоний на чашке Петри достигался
одинаковый, как при температуре 24 °С, так и при 28 °С. Повышение
температуры на 4 и 8 °С от оптимальной (т.е. 24 °С) было благоприятнее для развития штаммов Laetiporus conifericola, чем понижение ее до 16 и 20 °С. В связи с этим, штаммы этого вида следует считать
мезофилами.
Изучение влияния рН среды проводили путем культивирования штаммов на
капустном агаре, со следующими значениями этого показателя: 3,5;4,5; 5,5; 6,5 и
7,5.Исследования показали, что самые высокие
показатели роста наблюдали при значении рН – 3,5, тогда как самые низкие – при
рН 7,5. В среднем динамика роста штаммов Laetiporus conifericola при различных значениях рН отличалась мало, как и ростовой коэффициент. Можно
утверждать, что исследуемые штаммы имеют большой диапазон роста, как в кислой
среде, так и в слабо щелочной.
 Влияние света на штаммы Laetiporus conifericola определяли по выходу
биомассы и накоплению каротиноидов путем жидкофазного погруженного культивирования
на свету c освещенностью 500 лк (с фотопериодом
12:12 час) и в темноте на оптимизированной для каждого штамма среде. Она представляла
собой модифицированную стандартную питательную глюкозо-пептонную среду [2], в
которой пептон заменяли на молочную сыворотку. По окончанию культивирования
измеряли количество биомассы весовым методом и количество каротиноидов методом
экстракции [6].
Влияние света на штаммы Laetiporus conifericola определяли по выходу
биомассы и накоплению каротиноидов путем жидкофазного погруженного культивирования
на свету c освещенностью 500 лк (с фотопериодом
12:12 час) и в темноте на оптимизированной для каждого штамма среде. Она представляла
собой модифицированную стандартную питательную глюкозо-пептонную среду [2], в
которой пептон заменяли на молочную сыворотку. По окончанию культивирования
измеряли количество биомассы весовым методом и количество каротиноидов методом
экстракции [6].
а б
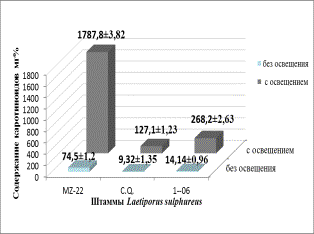
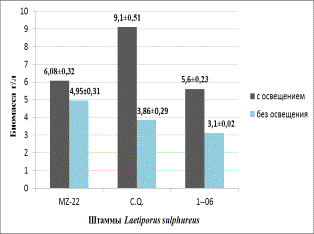
Рисунок 1 – Влияние освещенности на прирост
биомассы (а) и биосинтез каротиноидов (б) штаммами Laetiporus conifericola
В результате исследований установлено, что культивирование в условиях освещения оказывает положительное
влияние на биосинтез каротиноидов и рост биомассы мицелия у всех штаммов Laetiporus conifericola. Так, выход
биомассы увеличился в 1,2-2,3
раза, а накопление каротиноидов в 14-24
раза по сравнению с аналогичными параметрами при культивировании в отсутствии
света (рисунок 1а и 1б). Полученная биомасса
после культивирования в условиях света отличалась яркой красно-оранжевой
окраской по сравнению с биомассой,
полученной при культивировании без освещения: цвет
мицелия которого был желтым и светло-оранжевым.
Таким образом, для культивирования
штаммов Laetiporus conifericola оптимальной
питательной средой является капустный агар c молочной сывороткой, а благоприятные условия: температура 24 ºС,
значения рН 3,5-4,5 и условия
освещенности.
Список
литературы
1. Гвоздкова Т.С., Черноок Т.В., Пленина
Л.В., Лопатенто Ю.С., Романовская Т.Р., Игнатенко С.В. // Успехи медицинской
микологии. – 2005.Т.5. – С. – 257-259.
2.
Hee Sun Hwang, Sung Hak Lee, Yu Mi Baek .// Appl Microbiol Biotechnol.-2008.-Р.419-429.
3.
, , , , //Food
Chemistry. – 2007 –101,
N-1З-P.267-273
4.
Yoshikawa K. Bando, S., Arihara, E., Matsumura, S.,
Katayama// Chem. Pharm. Bull. 2001. V. 49.
P.327-329
5. Lindner D.L., Banik M.T. // Molecular phylogeny of Laetiporus and other brown rot polypore
genera in north America–2008-100, №3,-P.417-430
6. Капич,
А.Н. Антиокислительная активность экстрактов мицелия ксилотрофных
базидиомицетов / А.Н. Капич // Микология и фитопатология. – 1995. – Т. 29, №
5–6. – С. 35–40