Н.Б. Егоров
Томский
политехнический университет
Исследование
продуктов взаимодействия
солей
скандия с тиосульфатом натрия
Отделение скандия от примесей достаточно
сложная задача, т.к. концентрации сопутствующих элементов в комплексном сырье
из которого извлекается скандий, многократно превышают его концентрацию. Одним
из способов концентрирования скандия является осаждение его малорастворимых
соединений, таких как фторид, оксалат, карбонат и гидроксид.
Осаждение скандия тиосульфатом натрия,
предложенное Мейером, впервые позволило достигнуть за одну операцию
значительного отделения элементов иттриевой группы от скандия. Предполагается,
что при взаимодействии хлорида или нитрата скандия с тиосульфатом натрия
образуется основной тиосульфат скандия ScOHS2O3. Однако получение тиосульфатов d - и f -
элементов третьей группы, а также цирконила в литературе подвергается сомнению.
Целью данной работы являлось изучение
продуктов, взаимодействия нитрата скандия с тиосульфатом натрия методами
химического, термического анализа и инфракрасной спектроскопии.
Продукты получали по трем вариантам: I) кипячением слабокислых растворов (рН~2) [2]; II) кипячением
нейтрализованных NH4OH растворов; III)
высаливанием продуктов этиловым спиртом. Образующиеся осадки после получения высушивались
в вакуумном эксикаторе.
Количество скандия, в образовавшихся
продуктах определяли комплексонометрическим титрованием с ксиленоловым
оранжевым. Для определения серы полученные осадки обрабатывали царской водкой.
При этом вся содержащаяся в осадках сера переходила в сульфатную серу,
содержание которой определяли гравиметрическим методом, после осаждения сульфат
– ионов раствором хлорида бария. Гидроксильные группы в осадке определяли по
реакции с KF. Элементную серу в полученных
осадках определяли гравиметрическим методом после ее экстракции
четыреххлористым углеродом. Количество воды в осадках находили из данных
дериватографического анализа, который проводили на анализаторе SDT Q600. ИК –
спектры снимали на ИК-Фурье спектрометре Nicolet 5700.
В табл. 1 представлены результаты
химического анализа полученных осадков.
Таблица 1. Результаты
химического анализа полученных осадков
|
Условия получения осадка |
Состав осадков, % |
||||
|
Sc3+ |
S (окисленная) |
OH- |
S (элементная) |
H2O |
|
|
Sc(NO3)3+Na2S2O3 pH=2 |
28,3 |
26,9 |
6,6 |
16 |
15,1 |
|
Sc(NO3)3+Na2S2O3 нейтрализованный |
30,5 |
22,6 |
11,8 |
12 |
9,1 |
|
Sc(NO3)3+Na2S2O3 высаливание спиртом |
31,1 |
22,4 |
12 |
10,5 |
8,5 |
|
теоретический состав ScOHSO3 |
31,7 |
22,54 |
11,97 |
– |
– |
|
теоретический состав Sc2(SO3)3×ScOHSO3 |
28,6 |
27,11 |
3,6 |
– |
– |
Как показали данные химического и
термического анализа, полученные продукты представляют собой сульфит скандия,
гидролизованный в зависимости от условий его получения. Состав образующихся
осадков, полученных из нейтрализованных растворов и при высаливании спиртом
соответствуют формуле ScOHSO3×2H2O. Осадки,
полученные из кислых растворов соответствуют формуле Sc2(SO3)3×ScOHSO3 и
содержат значительное количество элементной серы.
На рис. 1 приведены ИК спектры полученных
осадков. Как видно из рисунка в ИК – спектрах всех трех осадков наблюдаются
семь полос поглощения: 497 см-1; 640 см-1; 920 см-1;
1132 см-1; 1380 см-1; 1633 см-1; 3300 см-1.
Для сравнения был получен продукт осаждения скандия сульфитом натрия. В
его ИК – спектре присутствуют полосы:
475 см-1; 649 см-1; 919 см-1; 1134 см-1;
1390 см-1; 1648 см-1; 3056 см-1; 3550 см-1.
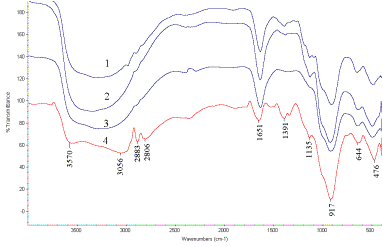
Рис. 1 ИК – спектры осадков, полученных: 1
– из нейтрализованных NH4OH растворов; 2 - высаливанием продуктов этиловым
спиртом; 3 - из кислых растворов (рН~2); 4 – по реакции нитрата скандия с сульфитом натрия.
Таким образом, ИК – спектр сульфита
скандия достаточно точно повторяет ИК - спектры продуктов, полученных тиосульфатным осаждением скандия. На
основании полученных результатов можно сделать вывод: из растворов, содержащих
нитрат скандия и тиосульфат натрия, при кипячении и высаливании происходит
осаждение основного сульфита скандия и соответственно ионом, ответственным за
осаждение скандия является сульфит-ион.
Реакцию осаждения скандия из растворов
тиосульфатом натрия можно представить следующей схемой:
2Sc(NO3)3+2Na2S2O3
+ 2H2O ® 2ScOHSO3 + S +
4NaNO3 + 2HNO3
3Sc(NO3)3+4Na2S2O3
+ H2O ® Sc2(SO3)3×ScOHSO3
+ 4S + 8NaNO3 + HNO3