Медицина/8. Морфология
Д.б.н. Дживанян К.А., к.б.н. Карапетян А.Ф., Григорян А.В.
Ереванский государственный университет, Армения
Об особенностях гистоморфологии печени и тонкой
кищки крыс при поступлении с кормом микотоксинов
Изучение реактивных изменений
тканей и клеток под воздействием загрязнения пищевых продуктов следует считать
весьма актуальной. Во всем мире в
настоящее время наблюдается высокий уровень загрязнения микотоксинами зерна и
других пищевых продуктов. Растительная пища загрязняется в результате жизнедеятельности как растущих
на растениях патогенных грибов, так и сапрофитных грибов, растущих на
продуктах. Животная пища, в особенности мясные и молочные продукты,
загрязняются микотоксинами главным образом из-за загрязненности кормов. Показано, что через 5 часов после кормления кур кормом,
содержащим афлатоксины, 31% яда обнаруживается в мышцах, 11% - в крови, 10% - в
печени (Huwig et al., 2001; Alwakeel, 2009).
Большинство микотоксинов термостабильны и не разрушаются даже при температуре
100оС, стойки также к влиянию кислот и щелочей. Попадая в организм человека и животных,
микотоксины не выводятся, накапливаются в тканях. При оценке действия
на организм микотоксинов важно учесть, что наличие в пище разных микотоксинов
приводит к более тяжелым последствиям даже в том случае, если содержание
каждого из них не превышает допустимую норму (Huwig et al., 2001; Fodor et al., 2006).
Следует
отметить, гистологические
и цитологические закономерности патологических изменений, возникающих при воздействии
микотоксинов, изучены недостаточно. Между тем, выяснение и исследование этих закономерностей совершенно
необходимы для создания теоретических основ профилактических и лечебных
мероприятий.
Исходя из
вышеотмеченного, мы поставили задачу гистологическими, гистохимическими и
морфометрическими методами изучить морфофункциональные особенности печени и
тонкой кишки крыс в условиях поступления с кормом смеси микотоксинов -
афлатоксина Б, охратоксина А и зеараленона.
Материал и методы. Материалом для нашей работы послужили печень и тонкая кишка крыс весом 150-200 г,
которыe ежедневно получали с кормом
смесь микотоксинов в дозе: афлатоксина B1 0,0257 мг, охратоксина А 0,0128 мг и зеараленона 0,0064 мг. Подопытные животные
были разделены на группы, которые отличались между собой по продолжительности
опыта. Животные первой группы ежедневно получали загряненный микотоксинами корм
в течение 15 дней, животные второй группы – в течение 30 суток, а животные
третьей группы – в течение двух месяцев. Контролем служили печень и тонкая
кишка крыс, содержащихся в одинаковых
усливиях с подопытными, но получавших незагрязненный корм. По завершении опыта
животные взвешивались и забивались декапитацией в условиях глубокого
обезболивания. Печень извлекалась и взвешивалась. Образцы печени и тонкой кишки
фиксировались в жидкостях Буена и Карнуа, подвергались общей гистологической
обработке и заливались в парафин. Серийные парафиновые срезы окрашивались
гематоксилином и эозином, в растворе Гимзы и Май-Грюнвальда по Паппенгейму, импрегнировались
серебром по Футу. В печени определяли соотношение клеток с темными и светлыми
ядрами, на срезах тонкой кишки определяли митотический индекс энтероцитов,
определяли количество тучных клеток на стандартной площади среза. Полученные
цифровые данные обрабатывались по компьютерной программе Statistica
7. Достоверность различий между опытом и контролем определяли с помощью таблицы
Стьюдента.
Результаты и обсуждение. Гистоморфологическое исследование тонкой кишки крыс, получавших в течение 1 месяца
загрязненный корм, выявило ряд деструктивных и дегенеративных изменений. Они проявлялись
главным образом в слизистой оболочке органа. В
составе эпителия кишечных ворсинок было
сильно увеличено количество бокаловидных клеток, заполненных слизью, высота
эпителия была уменьшена, энтероциты имели кубическую, местами и уплощенную
форму. Часто встречались энтероциты либо с пикнотически измененными ядрами,
либо некротизирующие. Хотя митотическая
активность клеток в этот срок наших наблюдений сохранялась на уровне нормы,
повышение частоты смертности клеток приводило к нарушению нормального ритма
физиологической регенерации эпителия а, местами - к нарушению его целостности и
слипанию между собой апикальных участков ворсинок. При этом, эпителий
слущивался небольшими группами сохранивших между собой связь дегенерирущих
клеток.
В течение первого
месяца поступления с пищей микотоксинов в кишечнике развивались также процессы
защитного характера. Они
находили свое выражение в первую очередь в увеличении количества лимфоцитов в
собственной пластинке слизистой оболочки непосредственно под эпителием, а также
между энтероцитами. Чаще, чем в норме в собственной пластинке и в подслизистой основе
встречались лимфоидные узелки (рис. 1).
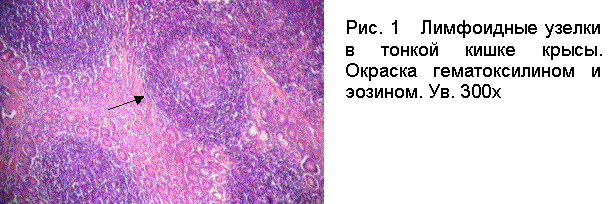

К числу явлений
защитного характера можно отнести также заметную активацию тучных клеток. Они, как известно, активно участвуют в
процессах воспаления, иммуногенеза и кровообращения, способствуя сохранению
местного гомеостаза. Свою защитную и регулирующую функцию тучные клетки осуществляют при помощи особых медиаторов, которые играют
важную роль в регуляции миграции эффекторных клеток, способствуя их адгезивным
взаимодействиям с клетками эндотелия. В кишечнике крыс тучные клетки локализуются в собственной пластинке –
в ворсинках и в области крипт. На 16-ые сутки наших опытов
количество тучных клеток хотя и не увеличивалось, но мы наблюдали четко
выраженную их дегрануляцию –активный
выброс содержимого цитоплазматических гранул. Цитоплазма дегранулированных тучных клеток, сохранив
ярко выраженную метахромазию, стала гомогенной, а в окружении клеток были
россыпи зерен метахроматичного вещества. Количество тучных клеток
увеличивалось.через 1 месяц после начала опыта. В этот срок они группами располагались в
собственной пластинке слизистой оболочки – между криптами и в подслизистой
основе. Большинство из этих
клеток было дегранулировано (рис. 2 ).


Гистоморфологическое
изучение печени крыс получавших микотоксины позволило выявить ряд изменений,
несущих главным образом деструктивный и патологический характер. Они
проявлялись уже на 16-е сутки поступления с кормом микотоксинов. В числе
гепатоцитов довольно часто можно было видеть некротизирующие, ядра которых были
почти растворены, а цитоплазма была оксифильна, встречались также клетки со
сильно гипертрофированными ядрами, нередки были также картины апоптоза
гепатоцитов. Проведенный в этот срок опыта подсчет количества гепатоцитов со
светлыми – бедными гетерохроматином, и темными – богатыми гетерохроматином
ядрами, выявил увеличение относительного количества последних. Т.к.
относительно большое количество гетерохроматина в ядрах и их темная окраска
оценивается как показатель низкой функциональной активности клеток, то на
основании этих данных можно заключить о подавлении функциональной активности
гепатоцитов под влиянием микотоксинов.
В этот срок опыта в
печени отмечались также защитного характера изменения, которые находили свое
выражение в увеличении клеточности междольковых прослоек соединительной ткани,
в высокой активности купферовских клеток, о чем можно было судить по увеличению их размеров.
Через 30 суток после начала
кормления крыс загрязненным микотоксинами кормом, деструктивные и
дегенеративные явления в печени становились более выраженными. В печени в этот
срок опыта можно было увидеть довольно большие поля некротизированных тканей.
Эти поля имели вид сетеобразного аморфного вещества в составы которого местами
были видны отдельные лимфоциты и макрофаги. Гепатоциты с темными ядрами по-прежнему в количестве
преобладали.
Через 2 месяца после
начала кормления крыс загрязненным кормом
деструктивные явления в тонкой
кишке стали более выраженными. Апикальные
участки некоторой части ворсинок были некротизированы. На их месте можно было
видеть оксифильную массу, содержащую отдельно разбросанные клетки крови,
фрагменты слущенного эпителия. Наряду с дестуктивными и дегенеративными
процессами в кишеччнике наблюдались также регенеративные и защитные явления. Благодаря
митотическому делению клеток эпителиальный покров проксимальных участков
поврежденных ворсинок был сильно утолщен и стал многорядным. Бокаловидные клетки в этих
участках эпителия были незаметны. В слизистой оболочке тонкой кишки крыс в этот
срок опыта количество тучных клеток еще более увеличивалось, что
свидетельствовало о состоянии реактивности органа, о высокой активности
выделения воспалительных медиаторов под влиянием микотоксинов. В этот срок
опыта в слизистой оболочке тонкой кишки была хорошо выражена также
лимфоцитарная реакция. На окрашенных по Паппенгейму препаратах в составе
эпителия и под эпителием выялялось много плазматических клеток. Этих клеток
было много в собственной пластинке слизистой оболочки, но многие из них, так
же, как лимфоциты, заходили в эпителиальный слой и контактировали с базальной
поверхностью энтероцитов..
Через 2 месяца после
начала поступления в организм крыс микотоксинов, масса печени была увеличена
(р<0,05), а дегенеративные явления в ней стали более выраженными. В числе
гепатоцитов было много с пикнотически измененными ядрами, поля
некротизированных тканей были весьма обширные (рис. 3 ).


О состоянии
повышенной реактивности органа свидетельствовали сильное расширение просвета
синусоидов, наличие большого количества макрофагов и лимфоцитов в составе
междольковой соединительной ткани.
Обобщая
полученные в нашей работе данные, можно
заключить о том, что поступление с кормом смеси микотоксинов афлатоксина Б,
охратоксина А и зеараленона в течение двух месяцев вызывает деструктивные и
дегенеративные изменения в печени и тонкой кишке, явно преобладающие над
защитными и компенсаторно-приспособительными.
Литература
1.
Alwakeel S.
S. The effect of mycotoxins found in some herbal plants on biochemical
parameters in blood of female albino mice /Pak J Biol Sci 2009, Apr 15;12(8),
p.637-642.
2.
Fodor
J., Meyer K., Riedlberger M., Bauer J., Horn P., Kovacs F., Kovacs M.
Distribution and elimination of fumonisin analogues in weaned piglets after
oral administration of Fusarium verticillioides fungal culture /Food Addit
Contam. 2006 May; 23(5), p.492-501.
3.
Huwig
A. , S. Freimund, O. Kappeli, H. /Dutler T oxicology Letters, 122 (2001), p.
179 188