Исследование влияния дигидрокверцетина на
уровень микроциркуляции и морфологические показатели при перитоните
(экспериментальное исследование)
А.Н. Чмыхова, Е.Б.
Артюшкова, Сеин О.Б., В.С. Барсуков
Перитонит
остается хирургической, общеклинической и общепатологической проблемой,
актуальность которой не снижается, несмотря на несомненные успехи клинической
медицины, вооруженной новыми перспективными технологиями (И.А. Ерюхин и соавт.,
2004). Приоритетные аспекты лечения перитонита связаны с внедрением
новых медицинских препаратов.
Большое значение приобретает применение
препаратов антиоксидантного действия, а именно биофлаваноидов, которые являются
естественными защитниками от «оксидативного стресса». Дигидрокверцетин (ДГК)
по своим химическим свойствам является активным антиоксидантом, т. е.
веществом, связывающим свободные радикалы и лишающим их повреждающего действия (Шестакова
М.В., 2006).
Показано, что включение ДГК в схемы
стандартной терапии различных заболеваний приводило к достоверному улучшению
показателей функций внешнего дыхания, центральной и периферической
гемодинамики, оксигенации крови, улучшению микроциркуляции, к повышению
толерантности к физической нагрузке, улучшению психоэмоционального состояния
больных и повышению терапевтического и реабилитационного эффектов лечения,
улучшению отдаленных результатов (Шакула А. В. И соавт., 2008; Плотников М. Б.
И соавт., 2005).
В связи с вышеизложенным, целью нашего
исследования являлась оценка эффективности использования ДГК путем анализа уровня
микроциркуляции и морфологических показателей при моделировании
распространенного перитонита.
Экспериментальное
исследование выполнялось на крысах-самцах линии «Wistar» массой тела 200-250 г. В контрольную группу входили крысы, у которых
моделировался перитонит. Распространенный перитонит вызывался путем внутрибрюшного введения 10% каловой
взвеси, которая вводилась в разных
направления в объеме 0,5 мл на 100 г массы тела животного.
В опытную группу вошли животные,
которым моделировали перитонит и вводили в течении 10 суток ДГК перорально в дозе 7,7
мг/кг/сут. Через 48 часов от начала
эксперимента в контрольной и опытной группах выполнялась санация брюшной
полости антисептическим раствором (0,02% раствор фурациллина) (Суковатых Б.С. и
соавт., 2010).
Для определения эффективности лечения ДГК
использовали следующие критерии: динамика
показателей уровня микроциркуляции в стенке тонкой кишки и гистологические
исследования.
Животных выводили из эксперимента на 1, 2, 3, 4,
5, 7 и 10-е сутки, после моделирования патологии, передозировкой средства для
наркоза – хлоралгидратом и осуществляли забор тканей из области повреждения для морфологического исследования.
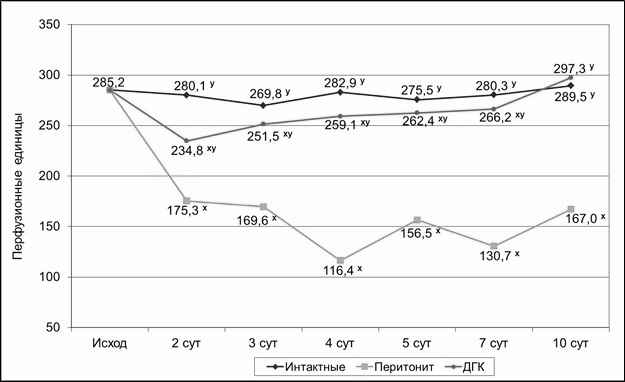
Рисунок 1. Динамика микроциркуляции в
стенке тонкой кишки крыс, получавших дигидрокверцетин в дозе 7,7 мг/кг/сут при
экспериментальном перитоните, в абсолютных значениях.
Примечание: х – р < 0,05 по сравнению с интактной
группой;
у – р < 0,05
по сравнению с контрольной группой.
При оценке уровня
микроциркуляции в опытной группе было выявлено, что введение экспериментальным
животным ДГК в качестве монотерапии приводит к эффективному повышению уровня
регионарного кровотока в стенке тонкой кишки (Рис. 1). На вторые сутки
эксперимента уровень микроциркуляции был на 33,9 % выше по сравнению с
контрольной группой животных. В дальнейшем на 3-и, 4-е, 5-е и 7-е сутки
отмечалось прогрессирующее повышение показателей микроциркуляции на 48,3 %,
122,6%, 67,7 % и 103,7 %, соответственно (р < 0,05). К десятым суткам
эксперимента у исследуемых животных, получавших ДГК, микроциркуляция в стенке
тонкой кишки полностью восстановилась до уровня интактных животных, в то время
как у крыс, не получавших лечения, оставалась на достоверно низком уровне (Рис.
1).
Анализируя динамику
морфологических изменений выявили следующую картину. Париетальная брюшина – на
2-е сутки после моделирования перитонита на фоне введения ДГК в париетальной
брюшине, как и при нелеченном перитоните, отмечается очаговая невыраженная воспалительная инфильтрация.
Тонкий и толстый
кишечник – на 4-10-е сутки воспалительные изменения в слизистой и
подслизистой оболочке выражены заметно слабее, чем у крыс контрольной группы.
Помимо этого отмечается выраженная гиперплазия лимфоидного аппарата кишечника,
что может быть обусловлено иммуномодулирующим действием ДГК. В толстом
кишечнике на 10-е сутки патологические изменения не выявляются.
Печень – на
2-е сутки общая архитектоника долек аналогичная таковой у крыс контрольной
группы, за исключением отсутствия колоний микробов в синусоидах. На 4-е сутки в
гепатоцитах выявляется картина очаговой
жировой дистрофии, но к 10-м суткам обнаруживается лишь зернистая
дистрофия гепатоцитов. Воспалительные изменения и микробная инвазия в печени
отсутствуют на всех этапах эксперимента.
Почки – на
2-4-е сутки изменения в клубочках почки и межканальцевой строме
аналогичны таковым у крыс контрольной группы, однако на 10-е сутки
патологические изменения в почках в виде дистрофических изменений эпителия
канальцев и интерстициального нефрита уже
не обнаруживаются.
Легкие – на
2-е сутки в альвеолярных перегородках выявляются нарушения микроциркуляции
аналогичные описанным у крыс контрольной группы, однако к 4 суткам эксперимента
они уже стихают и кровоизлияния в альвеолы не обнаруживаются. К 10-м суткам
эксперимента у выживших крыс отмечаются отчетливые гиперпластические изменения
перибронхиальной лимфоидной ткани, возможно, связанные с иммуномодулирующим
действием ДГК.
Селезенка
– на 10-е сутки эксперимента обнаруживается выраженная гиперплазия
лимфоидных фолликулов с появлением в них реактивных центров.
Летальность в
исследуемых группах изучалась у животных на всех сроках эксперимента. Процент
летальности рассчитывался как отношение числа погибших животных за сутки к
общему числу животных, взятых в эксперимент, с моделью экспериментального
перитонита.
В контрольной группе
из 50 животных за первые сутки погибло 10 крыс, что составило 20% летальности.
На вторые сутки эксперимента летальность составила 14%. На 3-и сутки сохранялся
высокий уровень летальности (10%), несмотря на выполненную через 48 часов после
моделирования патологии лапаротомию с целью санации брюшной полости
антисептическим раствором. Начиная с 4-х суток количество павших животных
уменьшалось, так летальность на 8-е сутки составила 2%, а на 9-е и 10-е сутки
летальность отсутствовала. К концу эксперимента на 10-е сутки общее количество
павших животных составляло – 31 крыса. Таким образом, из представленных выше
данных получено, что общая летальность в контрольной группе животных с
распространенным перитонитом составила 62%.
В группе животных,
получавших дигидрокверцетин в дозе 7,7 мг/кг/сут,
за первые сутки погибло 6 крыс, что составило 12% летальности. На вторые сутки
эксперимента летальность составила 8%. На 3-и сутки, после выполненной
лапаротомии через 48 часов после моделирования патологии с целью санации
брюшной полости антисептическим раствором, летальность снижалась до 4%. На 4-е
сутки количество павших животных не изменилось, летальность составила также 4%.
На 5-е и 6-е сутки количество павших животных уменьшилось, при этом летальность
составила по 2%, а с 7-х по 10-е сутки полностью отсутствовала. К концу
эксперимента на 10-е сутки общее количество павших животных составляло – 16
крыс. Таким образом, из представленных выше данных получено, что общая летальность
в группе животных, получавших лечение дигидрокверцетином в дозе 7,7 мг/кг/сут
на фоне моделирования распространенного перитонита, составила 32%.
Из полученных выше
данных видим, что в группе получавшей ДГК летальность крыс на 30% ниже, чем в
контрольной группе.
Нами экспериментально доказано, что введение антиоксиданта растительного
происхождения – дигидрокверцетина
прерывает каскад патологических процессов, формирующихся при распространенном
перитоните. Полученные результаты по уровню микроциркуляции и патоморфологическим
изменениям свидетельствуют о выраженном фармакологическом эффекте ДГК, что
предполагает использование ДГК как дополнение к стандартному лечению больных с распространенным
перитонитом.
Литература:
1.Ерюхин, И.А.
Перитонит и абдоминальный сепсис / И.А. Ерюхин, С.А. Шляпников, И.С. Ефимова //
Инфекции в хирургии. 2004. — №2(1).-С. 2-8.
2.Шестакова
М.В. Многокомпонентный подход к лечению сахарного диабета и его осложнений //
Терапевт. архив. - 2006. - №10. - С. 33-36.
3.Шакула
А. В., Некрасов В. И., Щегольков А. М., Климко В. В., Ярошенко В. П., Дергачева
Л. И. Применение дигидрокверцетина в комплексном лечении больных
гипертонической болезнью // Врач. 2008. № 4. С. 42–46.
4.Плотников
М. Б., Тюкавкина Н. А., Плотникова Т. М. Лекарственные препараты на основе
диквертина. Издательство Томского университета. 2005. 222 с.
5. Суковатых Б.С.,
Артюшкова Е.Б., Фролова О.Г. и др. Влияние мексикора на течение синдрома
интраабдоминальной гипертензии при экспериментальном распространенном
перитоните // Вестник экспериментальной и клинической хирургии. 2010 – Т.3, №3
– С. 222-226.
Сведения об авторах:
Чмыхова Анастасия Николаевна – ветеринарный врач I категории ОБУ «Курская городская
СББЖ»
Артюшкова Елена Борисовна – д.б.н., директор НИИ
экологической медицины ГБОУ ВПО КГМУ Минздрава России
Сеин Олег
Борисович – Член корреспондент
Российской академии естественных наук, заслуженный ветеринарный врач РФ, доктор
биологических наук, профессор
Барсуков
Владимир Сергеевич – д.м.н., профессор, заведующий кафедрой общей патологии и
физиологии Медицинского института Орловского государственного университета