Зоркин А.Я.,
Семенов С.В., Вавилина Н.А., Зарывахина О.И., Куц А.К.
Саратовский
государственный технический университет имени Гагарина Ю.А., Россия
Особенности работы выхода
оксидосодержащих катодов вакуумных электронных приборов
Оксидосодержащие
катоды вакуумных электронных приборов имеют высокие рабочие температуры, что
приводит к активным процессам испарения с катодов. Поэтому при анализе их
работы выхода необходимо учитывать также фазовое равновесие оксид – газ (пары
оксида), учет которого позволяет определять работу выхода по состоянию газовой
фазы [1]. Опубликованные данные по работе
выхода оксидосодержащих катодов часто не учитывают эту зависимость, хотя активность
кислорода внутри ВЭП существенно влияет на работу выхода [1].
Рассмотрим
влияние температуры, активности кислорода и внешнего напряжения на состояние системы
оксид – газ. Такая система в равновесии имеет две степени свободы, в качестве
которых рассмотрим температура Т и давление кислорода РО2.
Внутренняя работа выхода оксида jo=EC–EF определяется концентрацией свободных
электронов neo(T,РО2)
в зоне проводимости (при jo>>kT) [2]
|
|
(1) |
где
Nco(T)
– объемная плотность состояний на дне зоны проводимости оксида; k – постоянная Больцмана; e’ – заряд электрона; Т – температура; РО2
– давление кислорода.
Концентрация
электронов проводимости в объеме оксида находится независимо из решения
уравнения электронейтральности в объеме оксида с учетом уравнений баланса
структурных единиц или статистическим методом [2]. Концентрация
электронов проводимости при достаточно высокой температуре и избытке
кислородных вакансий над металлическими определяется концентрацией двукратно
ионизированных кислородных вакансий V’2O(T,PO2)
|
|
(2) |
|
|
|
где
No – концентрация узлов в решетке оксида; Kν(T)
– константа равновесия
реакции МО = 2 е + V2O + MM + 0.5 O2 (в реакции обозначено:
МО – твердый оксид, V2O –
двукратно ионизированные кислородные вакансии, MM
– ионы металла в узлах решетки; O2
– молекулярный кислород в газовой фазе).
Потенциальная
энергия электронов в вакууме относительно уровня Ферми равна
|
|
(3) |
где
neg(T,PO2) – концентрация электронов в парах оксида; Ncg(T) – плотность состояний в континууме.
Концентрация
электронов в ионизированном газе по распределению Саха равна (в предположении,
что ионизированы в основном атомы металла) [1]
|
|
(4) |
|
|
|
|
|
|
где
NM(T,PO2), PM(T,PO2) – концентрация и давление атомов металла в газе; GS – отношение статистических весов
электронов, ионов и атомов в газе; EiM – потенциал ионизации атомов металла в
газе; PA – атмосферное давление; KsM(T,n) – константа равновесия реакции MO = M+0.5O2.
Выражая
из (3) концентрацию электронов и приравнивая ее к правой части (4), получим
после преобразования
|
|
(5) |
где DGos(T,h,s), DGeg(T,h,g) –
энергии Гиббса образования из простых веществ
оксида и паров металла соответственно;
EiM(n), Eig(16) – потенциал ионизации атомов металла в
газе и молекул кислорода соответственно;
NF – число Фарадея; R – универсальная газовая постоянная.
Выражение
(5) может быть получено также из равенства нулю в равновесии энергии Гиббса
реакции МО = M2-
– O2 – 2 е (в реакции
обозначено: МО – твердый оксид, M2-
–
газообразные двукратно ионизированные ионы металла; O2 – молекулярный кислород
в газовой фазе; 2 е – два электрона).
Сродство
оксида к электрону равно [1]
|
|
|
где
neg(T,PO2) –концентрация электронов в ионизированном
газе паров оксида по распределению Саха [1];
neo(T,PO2) – концентрация электронов проводимости в
объеме оксида определяется квазихимическим методом [1]; me, m’e – масса свободного электрона и эффективная
масса электрона в зоне проводимости оксида соответственно.
Поверхностный
потенциал в равновесии, определенный из баланса заряда в переходе оксид – газ и
равенства поверхностных потенциалов в оксиде и в газе, равен [2]
|
|
|
где
KS –
коэффициент усреднения поля и заряда в переходе; ФX(KS) – функция, определяемая из решения
уравнения ФX
– ln((KS)2 ФX)=0.
Работа
выхода оксида (без учета дипольной составляющей) определяется из выражения [1]
|
|
|
При
увеличении температуры и уменьшении активности кислорода равновесный поверхностный
заряд оксида увеличивается и соответствует плотности донорных состояний на
поверхности 1015 … 1018 м-2 [1]. Такая
плотность значительно превышает поверхностную концентрацию кислородных
вакансий. То есть поверхностный заряд на оксиде создается донорными уровнями
адсорбированных или встроенных в решетку атомов ЩЗМ. Протяженность пространственного
заряда в газе в области перехода оксид-газ составляет 0.1 … 10 мм [1]. Это
свидетельствует о том, что в равновесии между катодом и анодом находится
равновесная плазма в парах оксида.
При
приложении внешнего напряжения равновесие в переходе оксид–газ нарушается.
Работа выхода оксида в режиме
пространственного заряда при токоотборе с
приложением внешнего напряжения Uak определяется
из выражения [2]
|
|
|
где
Vb(T,PO2,QSX,Uak) – понижающий работу выхода оксида общий
потенциал, который аппроксимируется выражением, полученным из решения уравнения
Пуассона для несимметричного перехода оксид – газовая фаза.
Поверхностный
заряд QS при наличии внешнего напряжения определяется из решения
уравнения [2]
|
|
|
где
Vj(T,PO2,Uak) – понижающий потенциал на поверхности
оксида, который определяется из условия, что ток подчиняется закону 3/2.
Поверхностный
потенциал связан с поверхностным зарядом выражением [1]
|
|
|
На рис. 1 показана
зависимость поверхностного заряда для оксида бария, а на рис. 2 - зависимость
эффективной работы выхода для оксида бария от внешнего напряжения при различных
температурах и активности кислорода в приборе.
2 1 3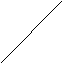
![]()
![]()
Рис. 1. Зависимость поверхностного заряда (Кл/м2)
от внешнего напряжения (В) для оксида бария.
1 – при Т=1100 К; 2, 3 – при Т=1200 К; 1, 2 – при активности кислорода в точке минимума общего давления над оксидом; 3 – в точке трехфазного равновесия металл-оксид-газ
1 2 3
![]()
![]()
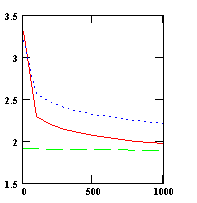
Рис. 2. Зависимость эффективной работы выхода (эВ)
от внешнего напряжения (В) в режиме пространственного заряда
для оксида бария. 1 – при Т=1100 К; 2, 3 – при Т=1200 К;
1, 2 – при активности кислорода в точке минимума общего давления над оксидом; 3 – в точке трехфазного равновесия металл-оксид-газ
При
увеличении температуры катода и внешнего напряжения в режиме пространственного
заряда и уменьшении активности кислорода в приборе поверхностный заряд и
потенциал увеличиваются, а эффективная работа выхода уменьшается, стремясь к
предельному значению, соответствующему току насыщения эмиссии
(экспериментальные значения работы выхода при токе насыщения составляют 1,2…2,5
эВ). Однако построенная модель неравновесного перехода оксид – газовая фаза
справедлива в области пространственного заряда и не позволяет определить ток
насыщения.
Литература
1. Откачка электронных
приборов / А. Я. Зоркин, Г. В. Конюшков. – Саратов: СГТУ, 2006. – 284 с.
2. Зоркин
А.Я. Адсорбционный механизм образования поверхностного заряда и работа выхода
оксидного катода // Перспективные направления развития
электронного приборостроения. – Саратов: Сарат. гос. ун.-т, 2003. – С. 108 – 113.
3.
Браун О.М., Пикус Г.Я., Чайка Г.Е. Расчет
динамически равновесного состава и электропроводности кристаллов при высокой
температуре в вакуумем // Физика твердого тела, вып. 9, 1975. – С.
768 – 770.
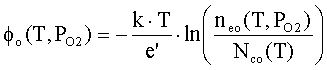
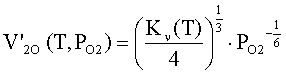 ,
,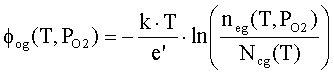
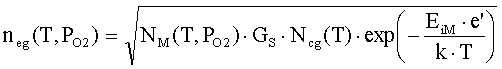
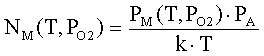 ,
,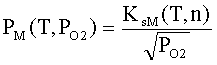 ,
,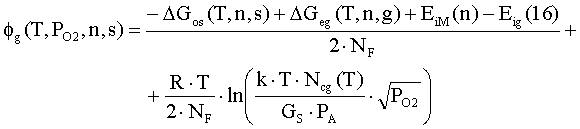
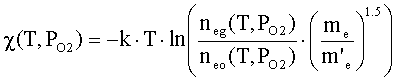
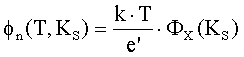
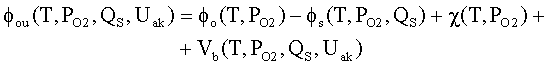 .
.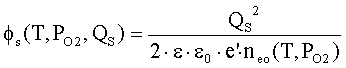 .
.