Д.х.н. Попова А.А.
Майкопский государственный технологический
университет, Россия
Исследование
электрохимического поведения
4d-, 5d-, 6d-металлов в спиртовых средах методом
электрохимического импеданса
Актуальность исследования влияния
электронного строения переходного металла и молекулы органического растворителя
на характеристики электрохимического окисления металлов, а также структуру и
параметры двойного электрического слоя, связана с широким использованием данных
процессов в электрохимической и противокоррозионной практике. Вместе с тем,
подобные исследования представляют теоретический интерес, так как расширяют
представления о природе пассивационных процессов на переходных металлах.
Исследования импедансометрическим и
потенциодинамическим методами проводили на электродах из Ti (99,97%), V
(99,99%), Nb (99,99%), Та (99,98%), Zr (99,99%), Мо (99,98%), W (99,99%) площадью 6 см2.
Образцы перед работой подвергали тщательной механической зачистке в инертной
атмосфере. Измерения проводили в термостатируемой электрохимической ячейке с
разделенными катодным и анодным пространствами. Электродом сравнения служил
насыщенный хлоридсеребряный электрод. Потенциалы пересчитывали относительно
ст.в.э.; в качестве вспомогательного электрода использовали платинированный
платиновый электрод площадью 20 см2.
Для приготовления рабочих сред
использовали безводный перхлорат лития и предельные алифатические спирты:
метанол, этанол, н-пропанол, н-бутанол. Природу спирта характеризовали с
помощью индукционной константы Гаммета σ*.
Содержание воды в рабочем растворе определялось хроматографически
непосредственно перед опытом и не превышало 1∙10-4 % (мольн.).
Обработку
результатов проводили с учетом статистических характеристик: дисперсии,
коэффициента вариации, среднего квадратичного отклонения. Воспроизводимым
считали результат, который при количестве вариант экспериментального значения n=10
показывал среднее квадратичное отклонение
![]() , дисперсию
, дисперсию ![]() . Доверительный интервал α принимали равным 0,96-0,98.
Коэффициенты корреляции полученных зависимостей
. Доверительный интервал α принимали равным 0,96-0,98.
Коэффициенты корреляции полученных зависимостей ![]() составляли не менее 0,987 – 0,999.
составляли не менее 0,987 – 0,999.
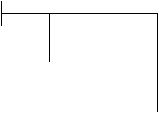
Включение в эквивалентную электрохимическую схему [1] адсорбционных емкости и сопротивления повышает коэффициент корреляции расчета элементов эквивалентных схем до 0,999 (рис. 1). Сопротивление Rадс уменьшается с переходом от метанола к бутанолу, емкость С2 –увеличивается. Зависимости носят линейный характер (рис. 2).
С1

![]() Rр R1
Rр R1
![]()
![]()
![]()
![]()
![]()
![]() Æ Æ
Æ Æ
![]()
![]()
![]()
![]()
![]()
![]()
![]() R2 С2
R2 С2
W
Рис. 1. Эквивалентная электрическая схема границы раздела электрод-раствор в системе Me, Ox / L: Rр – сопротивление раствора, R1, С1 – сопротивление переносу заряда и емкость двойного электрического слоя, не связанные с адсорбцией; С2, R2 – адсорбционные емкость и сопротивление; W– диффузионный импеданс Варбурга.
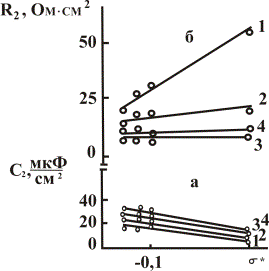
Рис. 2. Зависимость адсорбционных
емкости С2 (а) и сопротивления R2 (б)
от
σ* для титанового электрода в 0,1 М
перхлоратных спиртовых средах, при
потенциалах, В: 1 - -0,10; 2 –
0,43 (Екр);
3 – 0,44; 4 – 0,60.
Сопротивление переноса заряда W, рассчитанное по частотным зависимостям импеданса,
уменьшается с ростом σ* в ряду насыщенных спиртов. Изменение природы металла
в периоде Периодической системы приводит к увеличению W, в подгруппе - к снижению W (табл. 1).
Таблица 1. Электрохимические характеристики по данным
импедансных измерений для Zr, Сr, Мо, W в 0,1 М перхлоратных
растворах спиртов при Екр
|
M |
R |
W, Ом·см-2 |
io,
мкА/см2 |
n |
σ′ ∙103, Ом-1∙см-1 |
|
Zr |
Met |
23 |
1,12 |
1,96 |
26,5 |
|
Et |
9 |
2,85 |
1,92 |
32,5 |
|
|
Pr |
7,2 |
3,56 |
1,90 |
34,0 |
|
|
But |
7,0 |
3,67 |
1,98 |
35,1 |
|
|
Cr |
Met |
52,5 |
0,49 |
1,90 |
24,2 |
|
Et |
36 |
0,69 |
1,92 |
31,3 |
|
|
Pr |
25 |
1,04 |
1,90 |
32,5 |
|
|
But |
25,5 |
1,03 |
2,08 |
32,8 |
|
|
Мо |
Met |
50 |
0,51 |
1,90 |
22,5 |
|
Et |
39,5 |
0,65 |
1,91 |
29,1 |
|
|
Pr |
33,5 |
0,74 |
1,92 |
31,0 |
|
|
But |
21,5 |
1,19 |
2,10 |
33,4 |
|
|
W |
Met |
44,5 |
0,58 |
1,92 |
20,8 |
|
Et |
39,7 |
0,65 |
1,90 |
30,0 |
|
|
Pr |
22 |
1,16 |
1,90 |
32,0 |
|
|
But |
18,5 |
1,39 |
2,12 |
32,5 |
Токи обмена при анодном растворении
исследуемых металлов в перхлоратных растворах спиртов не велики. Природа спирта
отражается на величине io. С переходом от Met к But io увеличивается. Для Ti и Zr io больше, чем для металлов подгруппы хрома.
Для всех изученных систем стехиометрическое
число n~2, что подтверждает общность механизма анодного поведения всех
изученных металлов, наличие в нем общей лимитирующей стадии и формирование на
поверхности электродов пленок схожей природы [2]. Электропроводность пленок σ′
линейно увеличивается с ростом абсолютной величины константы Тафта σ* в
ряду метанол-бутанол, что также характеризует непосредственное участие
растворителя в формировании поверхностного пассивирующего слоя на цирконии и
металлах подгруппы хрома [3]. Образование структур, обеспечивающих перенос
заряда, доказывает наличие зависимости проводимости образующихся на поверхности
исследуемых металлов пленок σ′
от электронного строения металла.
Значение σ′ уменьшается при увеличении
порядкового номера металла в подгруппе Периодической системы (табл. 1).
Годографы импеданса, представляющие собой
прямые, не экстраполирующиеся в начало координат, характеризуют смешанный
диффузионно-кинетический контроль процессов анодного окисления всех исследуемых
металлов при Е≥ Екр [4].
Зависимость
проводимости σ′ от напряженности поля F в пленке характеризуется областью падения
σ′ при увеличении F более некоторой критической величины, сменяющейся
экспоненциальным ростом σ′. Зависимость
проводимости образующихся пленок от частоты f подчиняется соотношению ![]() , где s~0,95. Согласно данным литературы [5] это позволяет
предполагать, что электронный перенос в изучаемых системах осуществляется по
одному из видов прыжкового механизма переноса между локализованными d-орбиталями металла, реализуемого в случае
сильных полей в пленках на переходных металлах.
, где s~0,95. Согласно данным литературы [5] это позволяет
предполагать, что электронный перенос в изучаемых системах осуществляется по
одному из видов прыжкового механизма переноса между локализованными d-орбиталями металла, реализуемого в случае
сильных полей в пленках на переходных металлах.
Литература.
1.
Кичигин В.И.,
Шерстобитова И.Н., Шеин А.В. Импеданс электрохимических и коррозионных систем.
Пермь: ПГУ, 2009. 238 с.
2.
Дамаскин Б.Б., Петрий
О.А., Цирлина Г.А. Электрохимия. М.: Химия, 2001. 624 с.
3.
Попова А.А. Анодное
поведение переходных металлов в водных и органических средах. Ростов-на-Дону:
СКНЦ ВШ, 2006. 184 с.
4.
Стойнов З.Б., Графов
Б.М., Савова-Стойнова Б., Елкин В.В. Электрохимический импеданс. М.: Наука,
1991. 336 с.
5.
Брыксин В.В. Дьяконов
М.Н., Ханин С.Д. // Физика твердого тела. 1980. Т.22. С. 1403.