1. ВВЕДЕНИЕ
Каталитическая паровая и углекислотная
конверсия природного газа в обогреваемых трубах является одной из базовых
промышленных технологией современной промышленности. Она обеспечивает основное
сырьё для химии азота, полимеров,
прямого восстановления железа и металлургии цветных металлов. Процесс
превращения смеси углеводородов природного газа с водяным паром в
технологическую смесь водорода и окиси углерода используется или является
основой новых перспективных энергосберегающих технологий. Производство
технологического газа требует больших энергетических затрат, поэтому любые мероприятия по
энергосбережению принесут прибыль. В ОИВТ РАН разработан метод чередующихся
насадок, т.е. метод промежуточного перегрева в трубчатых печах. Этот метод
позволяет обеспечить энергосбережение за счет увеличения производительности
отдельной трубы, снижения затрат на производство технологического газа,
уменьшения гидродинамического сопротивления отдельной трубы и увеличения срока
службы катализатора [1]. Природный газ состоит в основном из метана и если его
количество превышает 5%, то химический
процесс приводят к метановому химическому эквиваленту [2].
Для исследований процессов переноса
использовалась следующая реакция: СН4 + Н2О +204кДж/моль
= 3Н2 + СО (1) . Видно, что эндотермический эффект велик (для
сравнения - на испарение Н2О требуется 41 кДж/моль). Этот факт
позволяет утверждать, что явления переноса тепла в основном определяют динамику
образования смеси СО и Н2 .
2. ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ.
Химическое
превращение по реакции (1) в промышленных агрегатах на практике неосуществимо,
т.к. в условиях стехиометрического отношения на полное химическое превращение
технически установленный теплообмен не обеспечивает нужный подвод тепла. Поэтому происходит реакция: СН4 + 78 кДж/моль = С + 2Н2 (2), на полное осуществление следующей
реакции: С + Н2О + 118 кДж/моль = СО + Н2 (3),
необходимый перенос тепла в установленной структуре обеспечить
невозможно. Поэтому свободный углерод в виде аллотропных наноструктур отлагается
внутри пор катализатора [3]. Углерод разрушает гранулы катализатора в порошок,
и в результате в трубчатой печи создаётся аварийная ситуация. Для прекращения
выделения углерода конверсию проводят с большим избытком Н2О над
стехиометрическим отношением. Запишем этот технологический приём в виде
следующего химического уравнения:
СН4
+ Н2О + nН2О = СО
+ 3 Н2 + nН2О
(4)
Чтобы
предотвратить зауглераживание катализатора, в промышленности используют 2<n<4. При таком избытке Н2О,
согласно теории столкновений, реакция (3) проходит достаточно интенсивно, так
что согласно реакции (2) углерод не успевает образовать аллотропные
наноформирования, разрушающие гранулы катализатора[1]. В промышленных печах в
трубы поступает смесь природного газа с водяным паром с n>2 при температуре
около 600К. Проходя по обогреваемым трубам, смесь реагирует и нагревается до
1100К. В этом случае эффективная скрытая теплота реакции Qэф равна не более
70кДж/моль, согласно формуле : ![]() ,
,
где
ΔН =204кДж/моль тепловой эффект реакции (1), n – количество молей избытка
окислителя и молей газов, не участвующих в реакциях (1), (2), (3), n=0 для
стехиометрии [1]. Для проведения
реакции (1) с n=0 было предложено сначала нагреть смесь СН4 и Н2О
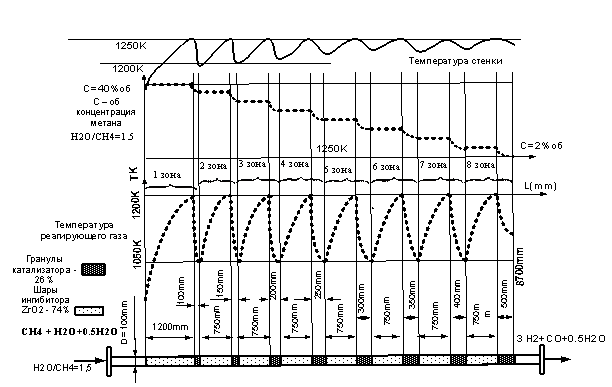
до температуры 1250К на ингибиторе реакции (1)– шарах из ZrO2 [4]. Распределение температуры и концентрации СН4
для стехиометрического отношения Н2О/СН4=1 (n=0) показано
на рис.1.
На рис. 1 видно, как нагревается
смесь СН4 и Н2О на шарах из ZrO2 и не
реагирует (концентрация ССН4 = const). При достижении температуры
газа, близкой температуре стенки, смесь поступает в слой катализатора, где
происходит активная реакция – зона наиболее активной реакции – ЗНАР. Здесь
начинает увеличиваться n и соответственно уменьшаться Qэф. Величина n возрастает за счет образования Н2 и СО. Перенос
тепла в этих условиях может обеспечить активное протекание реакции (3) и
углеродные наноструктуры не образуются и соответственно катализатор не
разрушается.
Однако температура, опустившись до известного минимума
Tmin, создаёт условия в имеющейся химической системе условия для протекания
реакций 2СО = СО2. + С (5)
и СО +Н2 = С + Н2О (6). На рис.1 эта зона обозначена ЗАОУ
– зона активного отложения углерода. По этому явлению ЗНАР делится на ЗНАР-1 и
ЗНАР-2.
Расчет кривых на рис. 1
проводился с использованием квазигомогенной модели, согласно следующей системы
уравнений (2А):
Реальная производительность химических аппаратов
определяется объёмной скоростью - v. Это объёмный расход размерностью нм3/ч
выбранного перерабатываемого продукта через аппарат объёмом 1м3. Режим, представленный на рис.1, имеет
скорость 250 ч-1. Если объёмную скорость увеличить до 300 ч-1, то в ЗАОУ
будет выделятся углерод и катализатор начнёт разрушаться. Для данного устройства насадок объемная
скорость 300 ч-1 является максимальной.
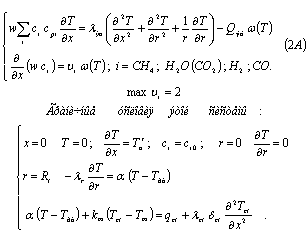
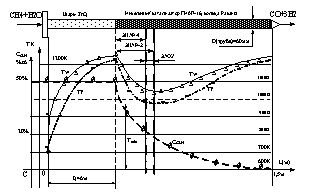
Рис.1
Изменение температуры реагирующего газа Tf,
температуры
стенки Tw и концентрации метана Cсн4
по длине трубы без отложений углерода.
Расход
метана 0,28∙10-3 нм3/с,
тепловой
поток 39 кВт/м2 ,давление 0,7 бар.
В промышленных печах объёмная скорость в трубах
современных трубчатых печей достигает
1800 ч-1. Для применения обнаруженного эффекта в промышленности
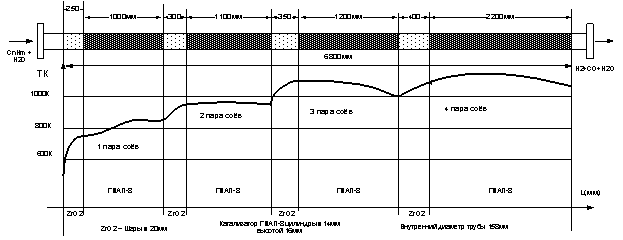
предложена схема чередующихся насадок [1].
Схема работает следующим образом. Сначала устанавливается слой
ингибирующей насадки, где происходит нагрев реакционной смеси до температуры
близкой температуре стенки. Далее идет слой катализатора такой длины, чтобы
падение температуры реагирующего газа не превысило 150К. Это участок, на котором имеет место наибольшая скорость
реакции. За слоем катализатора опять
устанавливается слой ингибитора ZrO2, в котором происходит повторный
нагрев реакционной смеси до температуры близкой температуре стенки. Далее
устанавливается опять слой катализатора, в котором происходит падение
температуры на 150К. Такое чередование слоёв устанавливается до конца
обогреваемой трубы. Расчеты выполнены для трубы промышленных размеров с
использованием квазигомогенной модели и записанной системы уравнений (2А)[1].
Получено, что система чередующихся насадок может увеличить производительность
рабочей трубы до объёмной скорости 2300ч-1 .